Большая энциклопедия нефти и газа. Металлические и неметаллические свойства простых веществ
Билет № 5
Неметаллы, положение этих химических элементов в периодической системе, строение их атомов (на примере атомов хлора, кислорода, азота). Отличие физических свойств неметаллов от металлов. Реакции неметаллов с простыми веществами: металлами, водородом и кислородом.
Неметаллы – это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.
Рассмотрим схемы строения атомов некоторых неметаллов:
N: 2е, 5е, 1s 2 2s 2 2p 3 высшая степень окисления равна +5, а низшая степень окисления -3.
О: 2е, 6е, 1s 2 2s 2 2p 4 высшая степень окисления равна +2, а низшая степень окисления -2.
Cl: 2е, 8e, 7е, 1s 2 2s 2 2p 6 3s 2 3p 5 высшая степень окисления равна +7, а низшая степень окисления -1.
С увеличение порядкового номера по периоду неметаллические свойства элементов усиливаются, а в группах – ослабевают: в VIA подгруппе О типичный неметалл, а полоний - металл.
Неметаллы при обычных условиях могут быть газами, жидкостями и твердыми веществами. Газами являются гелий, неон, аргон, криптон, хсенон, радон. Их называют инертными газами. Каждая молекула инертного газа состоит из одного атома; атомы этих элементов не объединяются в молекулы, т.к. внешние слои их атомов завершены (имеют по 8, кроме гелия, электронов).
Другие газы: водород, кислород, азот, фтор, хлор образуют двухатомные молекулы и имеют формулы: H 2 , O 2 , N 2 , F 2 , Cl 2 .
Единственное жидкое вещество, образованное неметаллом – это бром – Br 2 .
Остальные неметаллы твердые. Большинство неметаллов не электропроводны (графит и кремний проводят ток), имеют низкую теплопроводность, непластичны.
Чтобы выяснить свойства, характерные для всех неметаллов, надо обратить внимание на положение неметаллов в периодической системе элементов Д.И.Менделеева. Если провести диагональ от Be до At, то над этой диагональю в главных подгруппах окажутся элементы – неметаллы. К неметаллам относятся также водород и инертные газы. Таким образом, в VIIIA и VIIA – подгруппе все элементы – неметаллы, в VIA подгруппе – только полоний металл, в VA подгруппе неметаллы: N, P, As, в IVA - кремний и углерод, а в IIIA подгруппе - бор.
Неметаллы в основном располагаются в конце малых и больших периодов, а число внешних электронов у их атомов равно номеру группы. Исключение составляет гелий: на внешнем слое его находится 2 электрона, а сам он – в VIII группе.
Для завершения внешних электронных уровней атомы неметаллов присоединяют электроны и являются окислителями. Активнее всех присоединяет электрон атом фтора. Эта способность у остальных элементов-неметаллов уменьшается в следующем ряду: O N Cl Br S C I P H
У атомов этих элементов уменьшение способности присоединять электроны находится в соответствии с их электроотрицательностью.
Химические свойства неметаллов:
взаимодействуя с металлами, типичные неметаллы образуют соединения с ионной связью, например, хлорид натрия NaCl, оксид кальция CaO, сульфид калия K 2 S.
Приведем уравнения реакций:
2Na + Cl 2 = 2NaCl 2Ca + O 2 = 2CaO 2K + S = K 2 S
Итак, неметаллы могут реагировать с металлами, проявляя при этом свойства окислителей.
В определенных условиях неметаллы могут взаимодействовать друг с другом:
S+O 2 →SO 2 В этих двух реакциях сера проявляет свой
Неметаллы могут взаимодействовать со сложными веществами
А) с водой:Cl 2 +2H 2 O4HCl+2O 2 (на свету, или темп.)
Б) с солями: Cl 2 +2KBr2KCl+Br 2 (комн. t o)
В) со щелочами, при этом сера выступает в роли окислителя и восстановителя: 3S+6NaOH→2Na 2 S+Na 2 SO 3 +3H 2 O (кипячение)
Г) с кислотами – окислителями при нагревании: С + 2H 2 SO 4 (конц)→ СO 2 + 2SO 2 + 2H 2 O
С + 4HNO 3 (конц)→ СO 2 + 4NO 2 + 2H 2 O
Следует отметить, что для неметаллов скорее характерно различие, чем общность свойств.
«Химические свойства неметаллов» - Оксид углерода. Неметаллов. Уголь реагирует с веществами. Цель. В какой из реакций сера проявляет восстановительные свойства. Оксид серы (VI) не взаимодействует с веществом. Простое вещество сера. Взаимодействие с оксидами Ме и неМе. HNO3 окисляет неМе до соответствующих кислот. Окислительные свойства.
«Простые вещества - неметаллы» - Аллотропия углерода. Далее. Красный и белый фосфор. Применение аргона. Графит. Строение внешнего электронного слоя атомов гелия и неона. Кристаллическая, пластическая и моноклинная. Жидкие вещества - неметаллы. Применение гелия. Аллотропия кислорода. К неметаллам относятся инертные газы. В начало. Применение неона.
«Примеры неметаллов» - Карбин. Свободный углерод. Аллотропия. Биогенные элементы-неметаллы. Водородные соединения неметаллов. Сера. Особенности атомного строения элементов-неметаллов. Для неметаллов характерна разнообразная цветовая гамма. Фосфор. Характеристика простых веществ-неметаллов. Физические свойства простых веществ – неметаллов.
«Характеристика неметаллов» - Соединения с разными степенями окисления. Внутри каждого периода имеется «пограничная зона». Неметаллы занимают самые различные места. Элементы, проявляющие свойства металлов и неметаллов. Углерод, водород, кислород, азот, фосфор и сера. Переход от типичного металла к типичному неметаллу. Определите, окислителем или восстановителем является сера.
«Неметаллы» - Получение водорода. Физические свойства. Как вы думаете, в таблице больше металлов или неметаллов? Агрегатное состояние. Химические свойства неметаллов. Аморфное Кремний сера. Водород. Решетка) Красный фосфор – белый фосфор (строение молекулы Р2 и Р4). Положение в ПСМ. Химические свойства водорода. Газообразное Кислород, водород.
«Химия неметаллов» - Кислород. Презентация урока по химии для 9 класса. Красный фосфор. Аллотропия углерода. Алмаз. Общая характеристика и свойства неметаллов. Физические свойста неметаллов. Тема: НЕМЕТАЛЛЫ. Неметаллы в природе. Аллотропия. Неметаллы. Химическое строение и свойства металлов и неметаллов. Графит. Сера. К неметаллам относятся также водород Н и инертные газы.
Всего в теме 12 презентаций
Положение неметаллов в периодической системе.
Самой первой научной классификацией химических элементов было деление их на металлы и неметаллы. Эта классификация не потеряла своей значимости и в настоящее время.
Из 118 известных на данный момент химических элементов 22 элемента образуют простые вещества, обладающие неметаллическими свойствами.
Неметаллы располагаются в III-VII группах. По физическим свойствам к неметаллам следует отнести также VIIIА группу, или группу благородных газов. Неметаллы образуют p -элементы, а также водород и гелий, являющиеся s -элементами. В длиннопериодной таблице p -элементы, образующие неметаллы, располагаются правее и выше условной границы B-At.
| Группа | I | III | IV | V | VI | VII | VIII |
| 1-й период | H | He | |||||
| 2-й период | B | C | N | O | F | Ne | |
| 3-й период | Si | P | S | Cl | Ar | ||
| 4-й период | As | Se | Br | Kr | |||
| 5-й период | Te | I | Xe | ||||
| 6-й период | At | Rn |
Неметаллы - это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
2. Особенности строения атомов неметаллов.
У большинства атомов неметаллов от четырех до восьми валентных электронов во внешнем слое, но у атома водорода - один, у атома гелия - два, а у атома бора - три валентных электрона, небольшой радиус атома (орбитальный радиус меньше 0,1 нм). Поэтому атомы неметаллов стремятся довести недостающие до 8е. Это свойство атомов характеризуется электроотрицательностью. Для атомов неметаллов характерны высокие значения электроотрицательности. Она изменяется в пределах от 2 до 4.
В соответствии с ним неметаллы образуют особый ряд:
Фтор − самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, то есть проявлять восстановительные свойства.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах.
Неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами: в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.
Характеристики элементов неметаллов и их соединений закономерно изменяются в группах и периодах.
В периодах (с увеличением порядкового номера, т.е. слева и направо):
· увеличивается заряд ядра,
· увеличивается число внешних электронов,
· уменьшается радиус атомов,
· увеличивается прочность связи электронов с ядром (энергия ионизации),
· увеличивается электроотрицательность,
· усиливаются окислительные свойства простых веществ ("неметалличность") (кроме элементов VIIIA группы),
· ослабевают восстановительные свойства простых веществ ("металличность") (кроме элементов VIIIA группы),
· ослабевает основный характер гидроксидов и соответствующих оксидов,
· возрастает кислотный характер гидроксидов и соответствующих оксидов,
· валентность в соединении с кислородом возрастает от 3 до 7, высшая валентность равна номеру группы.
В группах (с увеличением порядкового номера, т.е. сверху вниз):
· увеличивается заряд ядра,
· увеличивается радиус атомов (только в главных подгруппах),
· уменьшается прочность связи электронов с ядром (энергия ионизации; только в главных подгруппах),
· уменьшается электроотрицательность (только в главных подгруппах),
· ослабевают окислительные свойства простых веществ ("неметалличность"; только в главных подгруппах) (кроме элементов VIIIA группы),
· усиливаются восстановительные свойства простых веществ ("металличность"; только в главных подгруппах) (кроме элементов VIIIA группы),
· возрастает основный характер гидроксидов и соответствующих оксидов (только в главных подгруппах),
· ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в главных подгруппах),
· снижается устойчивость водородных соединений (повышается их восстановительная активность; только в главных подгруппах),
· валентность элементов не изменяется и равна номеру группы.
Вида связи, характерные для неметаллов:
· ионная (КСI) ;
· ковалентная (неполярная − в простых веществах (С1 2)
· полярная − в соединениях неметаллов (SCl 2 ).
Однако следует особо остановиться на двойственном положении водорода в Периодической системе: в I и VII группах главных подгрупп. Это не случайно. С одной стороны, атом водорода, подобно атомам щелочных металлов, имеет на внешнем (и единственном для него) электронном слое один электрон (электронная конфигурация 1s 1), который он способен отдавать, проявляя свойства восстановителя.
В большинстве своих соединений водород, как и щелочные металлы, проявляет степень окисления +1, Но отдача электрона атомом водорода происходит труднее, чем у атомов щелочных металлов. С другой стороны, атому водорода, как и атомам галогенов, для завершения внешнего электронного слоя недостает одного электрона, поэтому атом водорода может принимать один электрон, проявляя свойства окислителя и характерную для галогена степень окисления -1 в гидридах − соединениях с металлами, подобных соединениям металлов с галогенами − галогенидам. Но присоединение одного электрона к атому водорода происходит труднее, чем у галогенов.
При обычных условиях водород Н 2 − газ. Его молекула, подобно галогенам, двухатомна.
Элементы VIII группы главной подгруппы − инертные или благородные газы, атомы которых имеют завершенный внешний электронный слой. Электронная конфигурация атомов этих элементов такова, что их нельзя отнести ни к металлам, ни к неметаллам. Они являются теми объектами, которые в естественной системе четко разделяют элементы на металлы и неметаллы, занимая между ними пограничное положение. Инертные или благородные газы («благородство» выражается в инертности) иногда относят к неметаллам, но чисто формально, по физическим признакам. Эти вещества сохраняют газообразное состояние вплоть до очень низких температур.
Инертность в химическом отношении у этих элементов относительна. Для ксенона и криптона известны соединения с фтором и кислородом. Несомненно, в образовании этих соединений инертные газы выступали в роли восстановителей.
3. Распространённость элементов-неметаллов.
Кислород и кремний являются наиболее распространенными элементами, на их долю приходится около 70% массы земной коры. К числу редких элементов относятся йод, селен, теллур и некоторые другие, на их долю приходятся тысячные доли процента массы земной коры. Многие соединения неметаллов являются обязательной составной частью растительных и животных организмов. К элементам-органогенам («рождающие» органические вещества: белки, жиры, углеводы, нуклеиновые кислоты) относятся: кислород О (на его долю приходится около 60% массы тела человека), С, Н, N, Р и S. В небольших количествах в организмах животных и растений содержатся F, О, I.
Два элемента-неметалла составляют 76% от массы земной коры. Это кислород (49%) и кремний (27%). В атмосфере содержится 0,03% от массы кислорода в земной коре. Неметаллы составляют 98,5% от массы растений, 97,6% от массы тела человека. В состав воздуха, которым мы дышим, входят простые и сложные вещества, также образованные элементами-неметаллами (кислород О 2 , азот, углекислый газ СО 2 , водяные пары Н 2 О и др.).
Водород − главный элемент Вселенной. Многие космические объекты (газовые облака, звезды, в том числе и Солнце) более чем наполовину состоят из водорода. На Земле его, включая атмосферу, гидросферу и литосферу, только 0,88%. Но это по массе, а атомная масса водорода очень мала. Поэтому небольшое содержание его только кажущееся, и из каждых 100 атомов на Земле 17 − атомы водорода.
4. Неметаллы − простые вещества. Строение.
В простых веществах атомы неметаллов связаны ковалентной неполярной связью; в благородных газах химических связей нет. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода Н 2 , галогенов Cl 2 , Вг 2), двойные (например, в молекулах кислорода) тройные (например, в молекулах азота) ковалентные связи.
Перейдем к рассмотрению строения молекул неметаллов. Неметаллы образуют как одноатомные, так и двухатомные молекулы.
К одноатомным неметаллам относятся инертные газы, практически не реагирующие даже с самыми активными веществами. Инертные газы расположены в VIII группе Периодической системы, а химические формулы соответствующих простых веществ следующие: He, Ne, Ar, Kr, Xe и Rn.
Некоторые неметаллы образуют двухатомные молекулы. Это галогены − F 2 , Cl 2 , Br 2 , I 2 (элементы VII группы Периодической системы), а также H 2 , N 2 , O 2 . Атомы озона, фосфора, серы - из большего числа атомов (O 3 , Р 4 , S 8), инертных газов – из одного атома (Не,Ne,Ar,Kr).
Для веществ неметаллов, находящихся в твердом состоянии, составить химическую формулу довольно сложно. Атомы углерода в графите соединены друг с другом различным образом. Выделить отдельную молекулу в приведенных структурах затруднительно. При написании химических формул таких веществ, как и в случае с металлами, вводится допущение, что такие вещества состоят только из атомов. Химические формулы, при этом, записываются без индексов - C, Si, S и т.д.
Самые типичные неметаллы имеют молекулярное строение, а менее типичные – немолекулярное. Этим и объясняется отличие их свойств.
1. Молекулярное строение. У этих неметаллов в твердом состоянии молекулярные кристаллические решетки. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому при обычных условиях большинство таких веществ представляют собой газы или твердые вещества с низкими температурами плавления и лишь единственный бром (Вг 2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярвого взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
Молекулярные неметаллы: H 2 , N 2 , P 4 (белый фосфор), As 4 , O 2 , O 3 , S 8 , F 2 , Cl 2 , I 2 . К ним же можно отнести и благородные газы (He, Ne, Ar, Kr, Kx, Rn), атомы которых являются как бы "одноатомными молекулами".
2. Атомное строение. У этих неметаллов атомные кристаллические решетки, поэтому они обладают большой твердостью и очень высокими температурами плавления.Эти вещества образованы длинными цепями атомов. Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Немолекулярные неметаллы: B (несколько аллотропных модификаций), C(графит), C(алмаз), Si, Ge, P(красный), P(черный), As, Se, Te. Все они твердые вещества, кремний, германий, селен и некоторые другие обладают полупроводниковыми свойствами.
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку . Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.
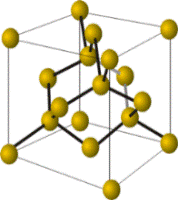
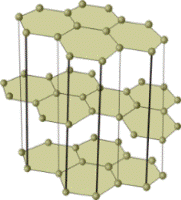
Модели кристаллических решёток алмаза (слева) и графита. Кристаллы этих аллотропных видоизменений состоят из атомов углерода, соединённых между собой ковалентными связями. Кристаллы графита, в отличие от кристаллов алмаза, сложены из отдельных слоёв, которые располагаются друг по отношению к другу подобно тому, как листы бумаги в книге.
Многие элементы-неметаллы образуют несколько простых веществ − аллотропных модификаций.
Аллотропия – это способность атомов одного химического элемента образовывать несколько простых веществ. а эти простые вещества – аллотропными видоизменениями или модификациями.
Аллотропия может быть связана и с разным составом молекул − различным числом атомов в молекуле (O 2 и O 3), и с разным строением кристаллов. Аллотропные видоизменения, образуемые одним и тем же химическим элементом, существенно отличаются между собой как по строению, так и по свойствам.
