Химия план характеристики элемента. Большая энциклопедия нефти и газа
Химия - наука, изучающая химические элементы, образуемые ими простые и сложные вещества (состав, строение, свойства), их превращения и законы, которым эти превращения подчиняются. Подразделяется на неорганическую, органическую, физическую, аналитическую, коллоидную и др. Современная химия связана с другими науками, в результате чего возникают пограничные области науки: биохимия, агрохимия, космохимия, радиохимия и др. Достижения современной химии являются стимулом интенсивного роста химической промышленности, играют важную роль в научно-техническом прогрессе всех отраслей народного хозяйства. Химия играет важную роль в решении наиболее актуальных и перспективных проблем современного общества (увеличение эффективности и безопасности искусственных удобрений для повышения урожайности сельскохозяйственной продукции и проблема синтеза продуктов питания из непродовольственного сырья; освоение океанических источников сырья; разработка и создание новых источников энергии; синтез новых веществ и композиций, необходимых для решения задач в будущем; охрана окружающей среды). См №2, с334.
Объектом изучения в химии являются химические элементы и их соединения. Химическим элементом называют совокупность атомов с одинаковым зарядом ядер. В свою очередь, атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Таким образом, каждому химическому элементу соответствует определённый вид атомов. См. №3, с11.
Молекулой называют наименьшую частицу индивидуального вещества, способную к самостоятельному существованию, обладающую его основными химическими свойствами и состоящую из одинаковых или различных атомов. Молекулы могут быть одно-, двух- и многоатомными. Они являются составными частицами вещества. Если молекулы состоят из одинаковых атомов, то вещество называют простым или элементарным, например He, Ar, H 2 , O 2 , O 3 , S 4 , P 4 . Простое вещество является формой существования химического элемента в свободном состоянии. См. №3, с11 – с12.
Если молекула вещества состоит из разных атомов, то вещество называют сложным (или химическим соединением), например CO, H 2 O, NH 3 , H 3 PO 4 . Любое вещество характеризуется определённым составом (природой и числом атомов в его молекуле), строением (пространственным расположением атомов в молекуле) и определёнными физическими и химическими свойствами. См. №3, с12.
Химические свойства вещества характеризуют его способность участвовать в химических реакциях, то есть в процессах превращения одних веществ в другие. Для понимания этих свойств необходимо знать состав и строение веществ. См. №3, с12.
Всю таблицу Менделеева можно разделить на металлы, неметаллы и амфотерные вещества. Металлы - простые вещества, характеризующиеся способностью отдавать электроны, расположенные на внешнем энергетическом уровне (валентные электроны) и переходить в положительно заряженные ионы. Практически все металлы обладают высокой электро- и теплопроводностью, способностью хорошо отражать световые волны (чем и обуславливается их блеск и непрозрачность), пластичностью. В твёрдом состоянии обычно имеют кристаллическое строение. Связь между атомами в металле осуществляется валентными электронами, которые свободно перемещаются в кристаллической решётке, образуемой положительно заряженными ионами металла. Из 107 элементов периодической системы, 83 элемента являются металлами. Многие эксплуатационные свойства металлов зависят не только от их химических свойств, но и от структуры, которую они приобретают в результате способов получения и последующей обработки. Это создаёт возможности широкого изменения свойств металлов и делает их важнейшими конструкционными, электротехническими, механическими и другими материалами. На сегодняшний день, металлы находят широкое применение в различных областях техники. Неметаллы - простые вещества, не обладающие ковкостью, металлическим блеском, являются плохими проводниками тепла и электричества. Для атомов неметаллов преимущественно характерна способность присоединять электроны, т.е. превращаться в отрицательно заряженные ионы. К неметаллам относятся 22 элемента: H, B, C, Si, N, P, As, O, S, Se, Te, галогены и благородные газы. Оксиды неметаллов носят кислотный характер, им соответствуют кислородсодержащие кислоты. Амфотерные вещества - вещества, которым свойственно проявлять как кислотные, так и основные свойства. Амфотерное вещество, реагируя, например, с сильным основанием, может проявить кислотные свойства, в то же время, это же вещество, реагируя с сильной кислотой, может проявить основные свойства. См №2, с273, с279, с225.
Рассмотрим периодическую систему химических элементов. Она создана на основании периодического закона. Таблица состоит из 7 периодов и 8 групп.
Периоды – горизонтальные ряды таблицы, они подразделяются на большие и малые. В мылах периодах находится 2 элемента (1-й период), либо 8 элементов (2-й и 3-й периоды), в больших периодах – 18 элементов (4-й и 5-й) или 32 элемента (6-й период). 7-й период пока не закончен. Любой период начинается с типичного металла, а заканчивается типичным неметаллом и благородным газом. См №1, с271.
Вертикальные столбцы называются группами элементов. Каждая группа делится на две подгруппы – главную и побочную. Подгруппа – совокупность элементов, являющимися химическими аналогами. Часто элементы подгруппы обладают высшей степенью окисления, соответствующей номеру группы. См №1, с271.
В главных подгруппах химические свойства элементов могут меняться в широком диапазоне от неметаллических к металлическим. В побочных подгруппах свойства элементов меняются не так быстро. См №1, с271.
В Периодической системе типичные металлы расположены в I группе (Li - Fr), II (Mg - Ra) и III (In, Tl). Неметаллы расположены в VII группе (F - AT), VI (O - Te), IV (N - AS), III (B). Некоторые элементы главных подгрупп (Be, Al и др.), как и многие элементы побочных подгрупп проявляют как металлические, так и неметаллические свойства, т.е. являются амфотерными. См №1, с271.
Для некоторых элементов главных подгрупп применяют групповые названия: I (Li - Fr) – щелочные металлы, II (Ca - Ra) – щелочноземельные металлы, VI (O - Po) – халькогены, VII (F - At) – галогены, VIII (He - Rn) – благородные газы. См №1, с271.
Оксиды
Оксиды – сложные вещества, молекулы которых состоят их двух элементов, одним из которых является кислород. По химическим свойствам делятся на 3 группы: основные, кислотные и амфотерные. Основные оксиды образованы только металлами (CaO, K 2 O, CuO CrO). Оксиды щелочных и щелочноземельных металлов образуют основания при взаимодействии с водой: CaO+H 2 O = Ca(OH) 2 Оксиды других металлов с водой не взаимодействуют и основания получают из соответствующих солей: FeSO 4 +2NaOH = Fe(OH) 2 +Na 2 SO 4 . Основные оксиды реагируют с кислотными оксидами и кислотами, образуя при этом соли: Na 2 O+SO 3 =Na 2 SO 4 ; CuO+2HCl=CuCl 2 +H 2 O. Кислотные оксиды образуются неметаллами (SO 3 , P 2 O 5 , CO 2) и металлами, проявляющими высокую степень окисления (Mn 2 O 7 , CrO 3). Многие кислотные оксиды образуют кислоты при взаимодействии с водой: P 2 O 5 +3H 2 O = 2H 3 PO 4 ; Некоторые из них не реагируют с водой и кислоты получаются из соответствующих солей. Кислотные оксиды взаимодействуют с осн6овными оксидами и основаниями, образуя при этом соли: CO 2 +3NaOH = Na 2 CO 3 +H 2 O. Амфотерные оксиды, в зависимости от условий, проявляют как кислотные, так и основные свойства, реагируют с кислотами и основаниями. К ним относят ряд оксидных металлов (Al 2 O 3 , ZnO, Cr 2 O 3 и др.):
Cr 2 O 3 +6HCl = 2CrCl 3 +3H 2 O; Cr 2 O 3 +2NaOH = 2NaCrO 2 +H 2 O
Все три типа оксидов являются солеобразующими. Также имеется особая группа оксидов, которая не проявляет ни кислотных, ни основных свойств. Их называют «Безразличными». К ним относятся: N 2 O, NO, SiO, CO и др. См №2, 276.
Гидроксиды
Гидроксиды – сложные вещества, образованные атомами некоторых элементов (кроме фтора и кислорода) и гидрооксогруппой ON ‑ :
X(OH) n , где n = ;
Различают (для n>2) орто- и мета- формы гидроксидов:
Мета-гидрксиды отличаются меньшим «содержанием воды», т.е. фактически являются орто-гидроксидами после дегидратации.
Кислотные оксиды (кислородсодержащие кислоты) всегда содержат атомы водорода, способные замещаться на атомы металлов.
Большинство типично кислотных гидроксидов находятся в мета-форме. При записи формулы кислотного гидроксида, атомы водорода ставят на первое слева место, учитывая его электролитическую диссоциацию в воде:
SO 2 (OH) 2 à H 2 SO 4 PO(OH) 3 à H 3 PO 4
NO 2 (OH) à HNO 3 CO(OH) 2 à H 2 CO 3
Основные оксиды содержат гидрооксогруппы, способные замещаться на кислотные остатки. Все основные оксиды находятся в ортоформе, они образованы катионами металлов M n + , где n=1,2 реже 3,4:
LiOH - Гидроксид лития
Ba(OH) 2 - Гидрокид бария
Cu(OH) 2 - Гидрокид меди (II)
La(OH) 3 - Гидрокид лантана (III)
Важнейшее химическое свойство основных и кислотных гидроксидов – взаимодействие их между собой с образованием солей (реакция нейтрализации или солеобразования):
a) Ca(OH) 2 +H 2 SO 4 (разб) = CaSO 2 ↓+2H 2 O
b) Ca(OH) 2 +2H 2 SO 4 (конц) = Ca(HSO 4) 2 ↓+2H 2 O
c) 2Ca(OH) 2 + H 2 SO 4 (разб) = Ca 2 SO 4 (OH) 2 ↓+2H 2 O
В реакции (a) протекает полная нейтрализация обоих гидроксидов (после реакции оказываются замещёнными все группы OH и все атомы H). В реакциях (b) и (c) – неполная нейтрализация кислотного и основного гидроксидов соответственно (два из четырёх атомов H или групп OH являются замещёнными). См №1, с 298
Соли
Соли – сложные вещества, в состав которых входят катионы металлов и анионы кислотных остатков. В том случае, если кислотный остаток не содержит водорода, соли называют средними:
CaSO 4 – Сульфат кальция
Средние соли являются продуктом полной нейтрализации гидроксидов:
3Ba(OH) 2 +2H 3 PO 4 = Ba 3 (PO 4) 2 ↓+6H 2 O
Средние соли вступают в реакцию двойного обмена с кислотными и основными гидроксидами и с другими солями:
Ag 2 CO 3 +2NO 3 = 2AgNO 3 +CO 2 +H 2 O
CuSO 4 +2NaOH = Cu(OH) 2 +Na 2 SO 4
Ca(NO 3) 2 +Na 2 CO 3 = CaCO 3 +2NaNO 3
Реакции, приведённые выше, являются распространёнными способами получения солей. Кроме того, средние соли образуются при взаимодействии металлов с кислотами:
Fe+H 2 SO 4 (разб) = FeSO 4 +H 2
Ca(HSO 4) 2 – гидросульфат кальция
Fe(HCO 3) 2 – гидрокарбонат железа (II)
Кислые соли – продукты неполной нейтрализации гидроксидов:
Ba(OH) 2 +2H 3 PO 4 = Ba(H 2 PO 4) 2 +2H 2 O
Возможна и дальнейшая нейтрализация кислых солей избытком основного гидроксида:
Ba(H 2 PO 4) 2 +Ba(OH) 2 = 2BaHPO 4 +2H 2 O
Сильные кислоты разрушают кислые соли слабых кислот, например:
Ba(H 2 PO 4) 2 +H 2 SO 4 = BaSO 4 +2H 3 PO 4
Ca 2 SO 4 (OH) 2 – дигидроксид-сульфат кальция
CoNO 3 (OH) – гидроксид-нитрат кобальта (II)
Основные соли – продукты неполной нейтрализации гидроксидов:
Co(OH) 2 +HNO 3 = CoNO 3 (OH)+H 2 O
Возможна и дальнейшая нейтрализация основных солей избытком кислотного гидроксида:
CoNO 3 (OH)+HNO 3 = Co(NO 3) 2 +H 2 O
Щелочи разрушают основные соли малорастворимых гидроксидов, если растворимость одного из продуктов меньше, чем растворимость исходной соли.
Тема: Характеристика химического элемента по его положению в периодической системе химических элементов.
Цели урока:
Научить составлять план общей характеристики элемента по его положению в периодической системе химических элементов; закрепить умение характеризовать элемент, его свойства и свойства его соединений по положению в периодической системе;
Развивать умение самостоятельно добывать и использовать необходимую информацию, умение делать выводы на основании полученной информации;
Формирование умения работать самостоятельно и в группе.
Тип урока: комбинированный.
Форма урока: индивидуальная, групповая.
Методы урока: прием развития критического мышления «древо знаний», самостоятельное выполнение заданий в группах, защита постеров, обучение через диалог учителя и учащихся.
Оборудование: ПСХЭ, раздаточный материал (яблочки, смайлики, оценочные листы, тест на самооценку для рефлексии,ватманы и фломастеры), интерактивная доска, презентация.
Ход урока
1.Организационный момент (3 мин). Приветствие.
Делим класс на 4 группы с помощью химических элементов. Учащиеся, вытянувшие карточки с одним и тем же элементом образуют одну группу. Элементы: натрий, алюминий, фосфор, хлор. Выбор спикеров, которые распределяют работу внутри группы и ведут оценочный лист.
Группам раздаются оценочные листы. Разъяснения по оценочному листу.
2. Проверка домашнего задания (11 мин). Учитель: Ребята, какую тему вы изучали на прошлом уроке? (ПЗ и ПСХЭ) Сегодня для проверки ваших знаний по этой теме я предлагаю вам следующее задание. Используем прием «Древо знаний». Учащиеся работают индивидуально. На интерактивной доске рисунок дерева с яблоками трех цветов: красные, желтые, зеленые. За каждым яблоком вопрос. Учащимся предлагается проанализировать свою работу при изучении предыдущей темы и, взвесив свои возможности, «собрать урожай», учитывая, что
«красные яблоки уже созрели» – они висят высоко, сорвать их тяжело - вопросы на них самые трудные,
«желтые яблоки» – висят ниже, сорвать легче – вопросы тоже легче,
«зеленые яблоки» – висят совсем низко, поэтому и вопросы самые простые.
Учащиеся по очереди выбирают яблоки и соответствующие вопросы. Ребята отвечают на вопросы устно, а учитель получает хороший материал для диагностики не только в освоении темы, но и уровня самооценки учащихся. Бумажные яблоки разных цветов раздаются детям за правильные ответы.
Вопросы для карточек зелёного цвета.
Кем и когда был открыт периодический закон? (Д.И.Менделеев. 1869 год)
Формулировка периодического закона, данная Д.И.Менделеевым. (Свойства элементов, а также состав и свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от их атомных масс)
Современная формулировка периодического закона. (Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атом этих элементов)
Что представляет собой период? (Период- это ряд химических элементов, расположенных в порядке возрастания атомных масс. Период начинается щелочным металлом и заканчивается инертным элементом)
Что такое периодическая система химических элементов? (Периодическая система химических элементов – это графическое изображение периодического закона и естественной классификации химических элементов)
Каким образом подразделяют периоды? Почему? (Малые периоды: 1-3 периоды содержат 2-8 химических элементов, большие периоды: 4-7 периоды содержат 18-32 химических элемента)
Что представляет собой группа? Сколько групп? (Группа – это вертикальные ряды, в которых располагаются элементы, принадлежащие к одному семейству с одинаковым количество внешних электронов и соответственно проявляющие одинаковые свойства. 8 групп.)
Какие элементы образуют главные подгруппы? (Элементы малых и больших периодов)
Какие элементы образуют побочные подгруппы? (Переходные элементы больших периодов)
Элементы каких групп образуют летучие соединения с водородом? (Элементы главных подгрупп IV-VII групп)
Вопросы для карточек жёлтого цвета.
Какие свойства химических элементов Д.И.Менделеев положил в основу их классификации? (Атомную массу, валентность химических элементов и свойства образуемых ими соединений)
Какой элемент из предложенных проявляет наиболее ярко выраженные неметаллические свойства: кислород, сера, селен, теллур? Объясните почему? (Кислород. В главных подгруппах сверху вниз неметаллические свойства ослабевают, а металлические усиливаются)
Как изменяются свойства химических элементов в периодах? (Слева направо металлические свойства ослабевают, неметаллические свойства усиливаются)
Какой элемент из предложенных проявляет наиболее ярко выраженные металлические свойства: магний, кальций, стронций, барий? Объясните почему? (Барий. В главных подгруппах сверху вниз металлические свойства усиливаются, неметаллические ослабевают)
У какого из предложенных элементов наиболее ярко выраженные неметаллические: магний, кремний, сера, хлор? Объясните почему? (Хлор. В периодах слева направо неметаллические свойства усиливаются)
У какого элемента из предложенных наиболее ярко выраженные металлические свойства: натрий, магний, алюминий, кремний? Объясните почему? (Натрий. В периодах слева направо металлические свойства ослабевают)
Вопросы для карточек красного цвета.
В чем основная причина изменения свойств элементов в периоде? (В постепенном увеличении числа протонов в ядре и числа электронов на внешнем энергетическом уровне)
В чем причина усиления металлических свойств элементов в главных подгруппах сверху вниз? (С возрастанием заряда ядер увеличивается число энергетических уровней, внешние валентные электроны отдаляются от ядра, связь с ядром ослабевает и соответственно усиливаются металлические свойства)
Почему изменилась современная формулировка периодического закона? (В связи с открытием строения атома. Главной характеристикой химического элемента является не его атомная масса, а заряд ядра его атома. Именно заряд ядра атома определяет количество электронов, а количество электронов в атоме и их распределение по уровням определяет свойства химических элементов и их соединений)
За каждый правильный ответ учащиеся получают соответствующего цвета яблоки. Зеленые яблоки- 1 балл, жёлтые-2 балла, красные- 3 балла.
Количество баллов учащихся на оценочных листах отмечают спикеры от каждой группы.
Оценочный лист
Группа _____________ Спикер _______________________
Количество яблок
Количест
во смай
ликов
Баллы по количеству яблок:
Зеленые-1 балл
Желтые-2 балла
Красные-3 балла
Баллы по количеству смайликов:
1 балл за каждый смайлик
Вс е го баллов
Оценка за урок
Зеленых-
Желтых- Красных-
Зеленых-
Желтых- Красных-
Зеленых-
Желтых- Красных-
Зеленых-
Желтых- Красных-
Зеленых-
Желтых- Красных-
Зеленых-
Желтых- Красных-
Перевод баллов в оценки:
1-4 балла – оценка «3»
5-8 баллов – оценка «4»
9 баллов и больше – оценка «5»
Спикеру необходимо ознакомить учащихся с их оценками внутри группы.
3. Изучение новой темы (6 мин).
Учитель: Ребята, вы изучили такие темы как «Состав и строение атома», «Периодический закон и периодическая система химических элементов». Сегодня на уроке мы с вами научимся давать характеристику химическому элементу по его положению в периодической системе химических элементов. Запишите тему урока в тетрадях «Характеристика химического элемента по его положению в периодической системе химических элементов». Главной характеристикой атома является его строение, т.е. такие характеристики как заряд ядра, распределение электронов по уровням, валентность. Скажите можем ли мы эти сведения получить из периодической системы химических элементов.
Давай вспомним и заполним таблицу, показывающую взаимосвязь главных характеристик Периодической системы со строением атома элемента.
Таблицу учащиеся чертят и заполняют в тетрадях.
Главные характеристики элементов и их взаимосвязь со строением атомов.
Вопросы, задаваемые в ходе заполнения таблицы:1. Что является главной характеристикой химического элемента в периодической системе химических элементов? (порядковый номер)
2. Что можно определить в строении атома по порядковому номеру химического элемента? (положительный заряд ядра, число протонов и общее число электронов)
3. Какие еще характеристики Периодической системы мы знаем? (номер периода, номер группы)
4. Что можно определить по номеру периода в котором находится химический элемент? (число электронных слоев в атоме этого элемента)
5. Что можно определить по номеру группы в котором находится химический элемент? (Число электронов внешнего электронного слоя (для элементов главных подгрупп), высшая валентность в кислородных соединениях)
За правильные ответы учащимся раздаются смайлики.
План характеристики химических элементов на основе теории строения атома и положения его в периодической системе.
2. Положение элемента в периодической системе химических элементов:Порядковый номер
Относительная атомная масса, А r
Период
Группа, подгруппа.
№12 элемент
А r ( Mg )=24
3-ий период
ІІ группа, главная подгруппа
3. Состав и строение атома элемента:
Состав атома
Распределение электронов по уровням
Электронная формула атома
Графическая электронная формула
24 _
12 Mg(12 р , 12n), 12 е
12 Mg)2)8)2
1s 2 2s 2 2p 6 3s 2 3p 0 3d 0
1 s 2 2s 2 2p 6 3s 2 3p 0
| 4. Свойства простого вещества, образованного данным элементом: Металл или неметалл, или же проявляет амфотерные свойства Высшая валентность | Mg - металл Валентность постоянная - ІІ |
| 5. Формула высшего оксида и летучего водородного соединения | Mg О - оксид магния, |
В ходе рассмотрения плана характеристики химического элемента учащимся задаются уточняющие и дополняющие вопросы, за ответы на которые учащимся раздаются смайлики:
1. Как определяют количество нейтронов в атоме? (находим по разности между относительной атомной массы и порядковым номером: N = А r - Z )
2. Как определяем максимальное количество электронов которое может разместиться на уровне? (по формуле N =2 n 2 )
3. Сколько электронов максимально может разместиться на первом, втором, третьем, четвертом уровнях? (на первом-2 электрона, на втором-8 электронов, на третьем-18 электронов, на четвертом-32 электрона)
4. Какие подуровни имеются на каждом уровне? (на первом уровне – s -подуровень, на втором- s и p -подуровни, на третьем – s , p и d -подуровни, на четвертом- s , p , d и f -подуровни)
5. Сколько электронов может разместиться на каждом из подуровней? (на s -подуровне 2 электрона, на p -подуровне 6 электронов, на d -подуровне 10 электронов и на f -подуровне 14 электронов)
6. Как можно определить по количеству внешних электронов свойства элементов? (1-3 электрона- металл, 4-8 электрона - неметалл)
7. Чему равна высшая валентность химического элемента в оксидах? (высшую валентность можно определить по номеру группы для элементов главных подгрупп)
4. Закрепление (18 мин). Учитель: Далее каждая группа выполняет следующие задания (на интерактивной доске). Оценивание этого задания осуществляет спикер. Спикер будет решать кому дать смайлик по следующим критериям: участие учащегося в выполнении задания на ватмане и выступление перед классом.
1 задание. Учащиеся каждой группы на ватманах дают характеристику тому элементу по которому они поделились на группы в начале урока: натрий, алюминий, фосфор, хлор.
Ответы учащихся:
Na, натрийAl, алюминий
P, фосфор
Cl, хлор
№11 элемент
А r ( Na )=23
3-ий период
І группа, главная подгруппа
№13 элемент
А r ( Al )=27
3-ий период
І І І группа, главная подгруппа
№15 элемент
А r ( P )=31
3-ий период
V группа, главная подгруппа
№17 элемент
А r ( Cl )=35,5
3-ий период
V ІІ группа, главная подгруппа
23 _
11 Na (11 р , 12n), 11 е
11 Na)2)8)1
1s 2 2s 2 2p 6 3s 1 3p 0 3d 0
1 s 2 2s 2 2p 6 3s 2 3p 0
27 _
13 Al (13 р , 14n), 13 е
13 Al)2)8)3
1s 2 2s 2 2p 6 3s 2 3p 1 3d 0
1 s 2 2s 2 2p 6 3s 2 3p 1
31 _
15 P (15 р , 16n), 15 е
15 P)2)8)5
1s 2 2s 2 2p 6 3s 2 3p 3 3d 0
1 s 2 2s 2 2p 6 3s 2 3p 3
35 _
17 Cl (17 р , 18n), 17 е
17 Cl)2)8)7
1s 2 2s 2 2p 6 3s 2 3p 5 3d 0
1 s 2 2s 2 2p 6 3s 2 3p 0
| Na - металл Валентность постоянная - І | Al - амфотерный элемент Валентность постоянная - ІІІ | P -неметалл V | Cl -неметалл Валентность переменная, высшая валентность - VII |
| Na 2 О - оксид натрия, летучее водородное соединение не образует | Al 2 O 3 - оксид алюминия, летучее водородное соединение не образует | P 2 O 5 - оксид фосфора ( V ), PH 3 | Cl 2 O 7 - оксид хлора ( VII ) летучее водородное соединение - HCl |
Учащиеся защищают свои постеры. Работу учащихся в группах оцениваем совместно со спикерами. Учитель: Спикер, кому из учащихся твоей группы за выполнение этого задания ты хотел бы дать смайлики? Раздаются смайлики членам групп.
Спикеры групп считают количество баллов по количеству яблок и смайликов.
Если останется время можно выполнить следующее задание.
Задание 2. (если останется время на его выполнение)
Задача для группы Na .
Назвать элемент по таким данным: находится в III группе, относительная молекулярная масса высшего оксида 102.
а) Алюминий; б)Скандий; в)Галлий.
Дано: Решение:
R2O3
Mr(R2O3)=102
Mr(R2O3)=102, Ar(O)=16
2x+16*3=102
2x=102-48
2x=54
x=27
R-?
Данная Аг соответствует элементу Al.
Ответ: Алюминий.
Задача для группы Al .
Назвать элемент по таким данным: находится во VI группе, относительная молекулярная масса высшего оксида 80.
а) Сера; б) Селен; в) Теллур
Дано: Решение:
RО3
Mr(RО3)
Mr(R О 3)=80, Ar(O)=16
R-?
x+16*3=80,
x=80-48=32
Данная Аг соответствует элементу S.
Ответ: Сера
Задача для группы P .
Назвать элемент по таким данным: находится в IV группе, относительная молекулярная масса высшего оксида 60.
а) Олово; б) Кремний; в) Углерод
RO2
Mr(RO2)=60
Mr(RO2)=60, Ar(O)=16
x+32=60
x=60-32=28
R-?
Дано: Решение:
Данная Аг соответствует элементу Si.
Ответ: Кремний
Задача для группы Cl .
Назвать элемент по таким данным: находится в V группе, относительная молекулярная масса высшего оксида 108.
а) Азот; б)Фосфор; в)Мышьяк.
Дано: Решение:
R2O5
Mr(R2O5)=108
Mr(R2O5)=102, Ar(O)=16
2x+16*5=108
2x=108-80
2x=28
x=214
R-?
Данная Аг соответствует элементу N.
Ответ: Азот
Домашнее задание (1 мин) §59, дать характеристику двум элементам: металлу и неметаллу по плану.
Оценивание (2 мин) Спикеры на оценочных листах проставляют баллы и оценки, знакомят членов группы с их оценками за урок.
Рефлексия (3 мин)
По результатам своей работы на уроке, вам необходимо установить степень достижения учебной цели и приобретение уверенности в своих знаниях.
Предлагаю проанализировать то, чему вы научились на уроке. Выполните тест.
Ф.И. учащегося___________________________________
Тест (для самоанализа полученных знаний и приобретенных умений)
а) план характеристики элемента по положению в периодический системеб) логическая последовательность характеристики элемента по положению в периодической системе
2) Я умею определять для элемента:
а) число элементарных частиц (протонов, нейтронов, электронов) в атоме
б) число энергетических уровней
в) электронную формулу
г) число электронов на внешнем уровне у атома
д) валентность элемента
е) высшую степень окисления элемента
ж) металлом или неметаллом является описываемый элемент
з) формулу высшего оксида и водородного соединения
3) Я умею сравнивать свойства элемента со свойствами соседних по периодической системе элементов
Подведение итогов.
§1. Характеристика химического элемента
Развитие теории строения атома и периодического закона позволило выявить ряд новых характеристик химических элементов и периодичности их изменений, а также активно использовать прогностические возможности периодической системы.
В качестве таких характеристик атомов элементов рассмотрим энергию ионизации, сродство к электрону и электроотрицательность.
В химических реакциях атомы элементов способны терять или приобретать электроны. Эта способность количественно определяется энергией ионизации атома или его сродством к электрону. Зная ее, можно предсказывать и объяснять химическое поведение элементов.
Способность атомов отдавать или присоединять к себе электроны зависит от их электронных структур, от того, насколько прочно валентные электроны удерживаются в атоме. Для металлов, имеющих небольшое число электронов на внешнем энергетическом уровне, более характерна способность к отдаче электронов, а для неметаллов, внешний электронный слой которых близок к завершению, характерна способность к притягиванию электронов.
Энергия ионизации – это энергия, необходимая для отрыва от атома наиболее слабо связанного с ним электрона.
Энергия ионизации выражается в килоджоулях на моль (кДж/моль). Допускается внесистемная единица – электронвольт (эВ/атом). 1 эВ = 1,6 × 10 19 Дж.
Чем меньше значение энергии ионизации, тем легче электрон отрывается от атома. Наименьшей энергией ионизации обладают щелочные металлы (498 кДж/моль для N а), наибольшее значение ее имеют элементы VIII группы (1519 кДж/моль для А r ). В главных подгруппах значение энергии ионизации уменьшается сверху вниз, в периодах увеличивается слева направо. Чем больше радиус атома и меньше электронов на внешнем слое, тем слабее удерживается электрон и тем меньше энергия ионизации.
Отдавая электрон или электроны, атом превращается в положительно заряженный ион.
Для неметаллов, наоборот, характерно принимать электроны. Атомы многих элементов способны не только отдавать, но и принимать электроны, превращаясь в отрицательно заряженные ионы.
Энергия, которая выделяется при присоединении одного электрона к атому, называется сродством к электрону.

Сродство к электрону также численно выражается в кДж/моль (или в эВ/атом). Присоединяя к себе электроны, нейтральные атомы превращаются в отрицательные ионы.
В периодах и группах периодической системы у элементов сродство атомов к электрону также изменяется закономерно в зависимости от их электронного строения. Наибольшим сродством к электрону обладают типичные неметаллы, наименьшим – типичные металлы. Элементы с наполовину заполненным внешним p -подуровнем (азот, фосфор, мышьяк) также имеют невысокое сродство к электрону.
Отдача или присоединение электронов атомами тех или иных элементов происходит обычно в процессе химического взаимодействия. Чтобы решить вопрос, какая способность у взаимодействующих друг с другом атомов преобладает (отдавать или приобретать электроны), следует учитывать и энергию ионизации, и сродство к электрону. Такой комплексной характеристикой атомов, учитывающей обе эти способности, является электроотрицательность элемента.
Электроотрицательность – способность атомов данного элемента оттягивать на себя электроны от атомов элемента-партнера.
Электроотрицательность измеряется полусуммой численных значений энергии ионизации и сродства к электрону атома данного элемента. Для удобства расчётов вместо абсолютных значений электроотрицательности обычно используют относительную электроотрицательность ОЭО.
Для этого электроотрицательность щелочного металла – лития принимают за единицу и сравнивают с ней электроотрицательность других элементов.
Наименьшие значения относительной электроотрицательности имеют щелочные металлы, наибольшие – галогены. В периодах с увеличением заряда ядра и усложнением электронных структур атомов элементов наблюдается рост значения относительной электроотрицательности. Зная относительную электроотрицательность элементов, можно прогнозировать возможность их атомов соединяться друг с другом. При взаимодействиях атомов разных элементов электроны смещаются от атомов с меньшей к атомам с большей относительной электроотрицательностью. Для удобства следует расположить известные элементы в порядке возрастания относительной электроотрицательности.
Законы природы обладают прогностическими функциями (т. е. позволяют прогнозировать развитие и результаты происходящих событий, процессов и т. п.). Периодический закон и отражающая его периодическая система таят огромные возможности для предсказания и описания свойств известных элементов, для открытия неизвестных элементов.
§2. Свойства химического элемента
В описании элементов и предсказании их свойств особую роль приобретает порядковый номер, с которым связано положение (место) элемента в периодической системе. Для разносторонней характеристики элемента надо знать не только его порядковый номер, но и его положение в периоде, группе, подгруппе.
При самостоятельном составлении характеристики того или иного элемента следует активно применять такие методы и приёмы познания, как описание и анализ свойств элементов на основе их сравнения и аналогии, давать классификацию элементам, предсказывать их свойства. Широко использовал подобные методы при открытии периодического закона и Дмитрий Иванович Менделеев.
Рассмотрим их применение на примере характеристики элемента с порядковым номером 15.
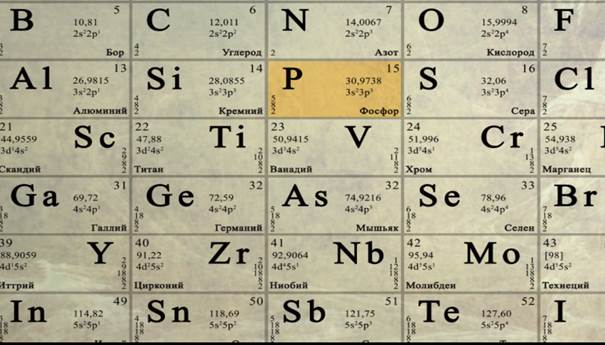
Это фосфор. Следовательно, заряд ядра его атомов +15, число электронов также равно 15. Фосфор расположен в 3-м периоде и V группе главной подгруппы элементов. У его атомов пять валентных электронов в наружном слое. Его высший оксид имеет форму Р 2 О 5 и кислотный характер, газообразное водородное соединение его – РН 3 . Фосфор – неметаллический элемент. Чтобы дать более полную и обстоятельную характеристику элемента, следует сравнить свойства фосфора и свойства его соединений со свойствами элементов – соседей по периоду кремния и серы и с элементами – аналогами по подгруппе – азотом и мышьяком. При обобщенной характеристике элементов надо учитывать не только его индивидуальность, но и периодическую изменяемость свойств окружающих его элементов в периодах и подгруппах
Литература:
Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Для визуального оформления использовались источники:
