«Общая характеристика неметаллов
Урок химии, 9 класс
тема "Неметаллы. Общая характеристика неметаллов"
Тип урока: урок усвоения новых знаний (урок работы с понятием и поиска фактов)
Цели: 1.Сформировать понятие «неметалл»;
2.Рассмотреть относительность понятий «металл-неметалл»;
3.Развивать мыслительные операции анализ, синтез, сравнение;
4.Отработка умения работать по плану, умения работать с текстом умения делать самостоятельные выводы.
Фундаментальные образовательные объекты, в направлении которых планируется деятельность учеников: понятие «неметаллы», закон единства и борьбы противоположностей, закон перехода количественных изменений в качественные.
ФОПД : фронтальная, индивидуально-обособленная, групповая (динамические группы).
Технологии: технология интеллектуальной воспитанности учащихся; технология сотрудничества, личностно-ориентированное обучение, ТКРЧЧП; информационно-коммуникативные технологии.
Оборудование и реактивы: АРМ учителя, специальная научно - популярная учебная литература, химические и энциклопедические словари, периодическая система, образцы неметаллов - простых веществ H2, O2 (в пробирках с пробками); Br2 (в ампуле); S, J2, P (красный), активированный уголь, йодкрахмальная бумажка.
Методы и приемы обучения: словесные (рассказ, объяснение, беседа); иллюстративные (схемы); наглядные (ПСХЭ, презентация); проблемно-поисковый, прием незаконченного предложения, прием «Антонимы»
Ход урока
| Этап урока, слайды презентации | Деятельность учителя | Деятельность ученика |
| I Организационный момент (1 мин) | - приветствие, настрой на работу Здравствуйте, рада вас видеть готовыми к уроку, с доброжелательными улыбками и серьезным настроем на урок! - контроль посещаемости Приятно, что сегодня присутствует на уроке весь класс | Приветствуют учителя, дежурные сообщают о явке на урок |
| II. Мотивационно-целевой этап (7 мин) |
||
| СЛАЙД № 1 | 1.Актуализация знаний 1 задание Ответьте, пожалуйста, на вопросы, рассмотрев внимательно предложенную вам картинку: 1.Что вы можете рассказать об увиденном на слайде? 2.Как вы считаете, где здесь причина, а где следствие, объясните, почему? 3.Кто сможет назвать тему, над которой мы работали во второй четверти? 4. Кто может указать местоположение ме в ПС? | Рассматривают слайд, отвечают на вопросы: Изображены металлы и изделия из них, внешний энергетический уровень железа и кристаллическая решетка металлов; Причина - строение кристаллической решетки ме, следствие - свойства, благодаря которым можно изготовить эти изделия; Изучали металлы и их соединения; Нижний левый угол ПС, большая доля химических элементов. |
| СЛАЙД № 2
СЛАЙД № 3
| 2 задание Давайте, вместе с вами постараемся выполнить следующее задание «Продолжить пары по аналогии» Скажите, пожалуйста, а какой вывод можно сделать по результатам данного задания об этих двух понятиях. | Выполняют задание с места (после полученного ответа на презентации появляется нужное слово) Они противоположны по смыслу с т. зр. русского языка (приставка не-) следовательно, в науке химии они должны быть противоположны по положению ПС, строению атома, составу простых веществ и свойствам, как физическим, так и химическим |
| СЛАЙД № 4
СЛАЙД № 5
| 3 задание Давайте попытаемся этот вывод превратить в научную гипотезу, которую постараемся доказать в течение урока. | Формулируют гипотезу: ЕСЛИ понятия металл и неметаллы противоположны по смыслу, ТОГДА атомы и вещества входящие в данные группы будут отличаться по строению атома, составу и строению простых веществ, по физическим и химическим свойствам. (после полученного ответа в презентации гипотеза) |
| СЛАЙД № 6
СЛАЙД № 7
| Фронтальная беседа: 1)Какова тема нашего урока? Запишите ее в тетрадь 2)Почему нам необходимо изучить данное понятие и все что за ним скрывается (атомы, вещества, свойства)? 3)Как вы считаете, какие мы должны поставить перед собой цели? 4)Кто сможет, зная местоположение металлов в ПС показать, где располагаются неметаллы? 5) А кто - нибудь из вас встречался с веществами группы неметаллы? (посмотрите на образцы веществ, выставленные на демонстрационном столе) | Неметаллы. Общая характеристика неметаллов. Записывают число и тему урока Что бы понять многообразие мира: изучили одну сторону, обязательно нужно посмотреть и на другую Формулируют с помощью учителя цели урока: 1.Сформировать понятие «неметалл»; 2.Рассмотреть относительность понятий «металл-неметалл»; 3.Будем анализировать учебный и дополнительный материал, устанавливать факты, сравнивать, делать выводы; 4.Отрабатывать умение работать по плану, умение работать с текстом. 5.Докажем выдвинутую гипотезу - Показывают у доски положение неметаллов в ПС Рассматривают образца, актуализируют собственный опыт, отвечают |
| III. Исполнительский этап (30 мин) |
||
| СЛАЙД № 8
СЛАЙД № 9
СЛАЙД № 10
| Хорошо! Молодцы! Итак, нам предстоит многое выяснить, поработать с незнакомой информацией из разных источников и постараться подтвердить или опровергнуть выдвинутую гипотезу, работать мы будем с вами и в парах, и в группах. 1 задание (выполняем в парах, 12 минут ):Прочитать внимательно имеющийся текст и уложить информацию в схему в течение 4 минут Итак, каждая пара, отвечает в порядке тем, которую вы видите на слайде: 1.ЧТО ТАКОЕ НЕМЕТАЛЛЫ 2.ОТ ЧЕГО ЗАВИСИТ АКТИВНОСТЬ НЕМЕТАЛЛА 3.ПОЧЕМУ НЕМЕТАЛЛЫ ПРОЯВЛЯЮТ ПОЛОЖИТЕЛЬНУЮ И ОТРИЦАТЕЛЬНУЮ ВАЛЕНТНОСТЬ 4.АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВ 5.МЕСТО НЕМЕТАЛЛОВ В ПРИРОДЕ (СЛАЙД № 9) 6. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ В ЖИВОЙ КЛЕТКЕ 7. ОСОБЕННОСТИ СТРОЕНИЯ НЕМЕ 8. ФИЗИЧЕСКИЕ СВОЙСТВА, АЛЛОТРОПИЯ НЕМЕ. | Читают предоставленный материал (заранее подготовленные учителем тексты про простые вещества и элементы неметаллы в определенной последовательности, см. приложение) записывают в тетрадях вариантыпо предложенным схемам (прием «Незаконченное предложение») Главная мысль прочитанного….. (Основное в тексте….) Самым интересным нам показалось…..(Необычным стало…) Мы считаем, что это подтверждает (не подтверждает) выдвинутое предположение Отвечает каждая пара по своему материалу |
| Личные презентации обучающихся по индивидуальным заданиям | 2 задание (10 мин): Вы хорошо поработали. Но наша с вами возможность получить необходимое знание не ограничивается только печатной информацией. Я попрошу ребят, которые вчера получили индивидуальные задания для работы в интернете, представить результат. Спасибо, мы услышали и увидели, что информация интернета многообразна, ребята сделали тщательный анализ, и правильные выводы - информация из интернета не всегда соответствует действительности и поэтому требует осторожного отношения и проверки! | Индивидуальные сообщения учащихся у доски: 1 ученик - словари, определения 2 ученик - сайты с интересными сведениями про неметаллы 3 ученик - картинки, фото 4 ученик - видео 5 ученик - анализ школьных мультимедийных пособие |
| 1 группа - словари 2 группа - научно-популярные издания 4 группа - контрольно - измерительные материалы | 3 задание: А теперь объединяйтесь в 4 большие группы и следующие задание, у каждой группы на столе литература, необходимо поработать с ней: НАЙТИ ИНФОРМАЦИЮ ПО ИЗУЧЕННОМУ ПОНЯТИЮ И ОПРЕДЕЛИТЬ ЕЕ ХАРАКТЕР (8 минут) Спасибо, вы сумели представить нам разнообразие информации по неметаллам, которая пригодиться нам в дальнейшем | Работа в группах по анализу представленной литературы. Подготовка выступления от группы Выступление: 1)Находят определения понятия неметаллы и анализируют его, сравнивая с собственным; 2) Находят информацию об условности деления химических элементов на металлы и неметаллы, анализируют ее; 3) Выясняют, что на примере этих двух понятий можно доказать основополагающие законы: закон единства и борьбы противоположностей, закон перехода количественных изменений в качественные. |
| IV. Рефлексивный. Закрепление изученного (7 мин). |
||
| СЛАЙД № 11
| 1)Раздает информационный лист «Неметаллы» (см. приложение). Внимательно ознакомиться, что в нем, для чего он, что неясно? Убираем его в рабочую накопительную папку и анализируем состоявшийся урок. 2) Учащимся предлагаются вопросы: Подтвердилась ли гипотеза урока? Как изменило новое знание ваши представления об уже имеющихся знаниях? Что в новом знании вас удивило? Какое суждение вам кажется спорным, почему? Какой этап решения познавательной задачи вызвал затруднения? Какие суждения, умозаключения, гипотезы в ходе обсуждения вам удалось сформулировать самостоятельно? Чьи идеи вам показались интересными, удовлетворила или вызвала раздражение совместная работа? 3)Я очень рада, что наш урок вызвал у вас столько мыслей чувств и эмоций, я сегодня тоже очень довольна вами, мы много трудились и такой труд заслуживает поощрения. Учитель объявляет оценки за урок | Изучают информацию по неметаллов в виде опорной записи, объясняют его назначение - для лучшего запоминания и дальнейшей работы по теме, задают вопросы. Каждый обучающийся выбирает любой вопрос и проводит рефлексию. Выставляют оценки в дневник |
| СЛАЙД № 12
| 4) Нам осталось записать домашнее задание: Изучить информационную карту, внести в нее недостающую информацию, выполнить тест, индивидуально: найти интересные химические реакции с неметаллами Спасибо за работу! | Записывают домашнее задание Благодарят учителя и друг друга! |
Конспект урока по химии.
Тема урока: «Общая характеристика неметаллов»
Возраст: 9 класс
Учителя химии МКОУ «Большескуратовская СОШ»Чернского района Тульской области
Морозовой Галины Александровны
Цель урока: дать общую характеристику неметаллов.
Задачи урока:
актуализировать знания учащихся о физических свойствах неметаллов, о типах кристаллических решеток;
развивать умения применять знания, сравнивать и делать выводы;
воспитывать химическую аккуратность по отношению к окружающей среде.
Форма урока: изучение нового материала с элементами лекции.
Методы: объяснительно-иллюстративный.
Ход урока:
Организационный момент.
Актуализация опорных знаний.
На прошлых занятиях мы завершили изучение большой темы «Металлы», а сегодня мы приступаем к изучению нового объемного материала по теме «Неметаллы».
Итак, как вы уже знаете, все вещества, простые и сложные, состоят из атомов.
Что же такое атом?
Особая группа атомов, которая располагается в ПСХЭ Д.И. Менделеева называются химическими элементами.
На какие две группы делятся химические элементы?
Все химические элементы делятся на металлы и неметаллы. При чем из 109 х.э. только 22 являются неметаллами.
Откройте рабочие тетради и запишите тему нашего занятия «Общая характеристика неметаллов».
Цель урока : дать общую характеристику неметаллов.
Изучение нового материала.
Положение неметаллов в ПСХЭ Д.И. Менделеева.
Где в ПСХЭ Д.И. Менделеева располагаются неметаллы?
Неметаллы располагаются вдоль диагонали вор – астат и выше нее, т.е. в верхнем правом углу ПСХЭ.
Особенности электронного строения атомов неметаллов.
Надо отметить, что для неметаллов характерно скорее отличия в свойствах, чем сходство, как у металлов. Одним из немногих критериев схожести неметаллов является электронное строение.
Рассмотрим электронное строение атомов неметаллов в сравнении с электронным строением атомов металлов.
О чем говорит электронное строение атома кальция?
Сколько может быть электронов на внешнем уровне атома металла?
У какого металла на внешнем уровне атома находится 3 электрона?
Какие свойства проявляют металлы?
Запишите схему отдачи электронов атомом кальция.
О чем говорит электронное строение атома хлора?
Сколько может быть электронов на внешнем уровне атома неметалла?
Почему же бор проявляет свойства неметалла, хотя у него на внешнем уровне всего 3 электрона?
Какие свойства проявляют неметаллы?
Запишите схему приема электронов атомом хлора.
Что можно сказать о размере атома металла и неметалла?
ВЫВОДЫ:
У неметаллов на внешнем уровне 4-8 электронов (исключение бор).
Они проявляют окислительные свойства.
Малый радиус атома.
Высокое значение электроотрицательности (Э.О.).
Электроотрицательноть.
Дайте определение Э.О.
Существует два рада активности:
Ряд активности металлов.
Ряд активности неметаллов
(демонстрация соответствующей таблицы).
Ряд активности металлов характеризует их восстановительные способности, т.е. меру их металличности. Ряд активности неметаллов характеризует их окислительные способности, т.е. меру их неметалличности.
Чем выше значение Э.О., тем:
Больше способность оттягивать электронную плотность атомов;
Больше неметаллические свойства атома;
Больше окислительные свойства.
Назовите самый активный неметалл?
Физические свойства неметаллов.
Физические свойства неметаллов мы рассмотрим в сравнении с металлами, параллельно заполняя табличку.
| Физическое свойство | Металлы | Неметаллы |
| Агрегатное состояние | Жидкое (ртуть) | Газообразное (О 2 , Н 2) Жидкое (Br 2) Твердое (C) |
| Цвет | Большинство металлов имеют серебристо-белый цвет | Черный (графит) Красный (Br 2) Желтый (S) Фиолетовый (I 2) Бесцветный(О 2 , Н 2) (учитель демонстрирует данные неметаллы) |
| Электро – и теплопроводность. | Электро – и теплопроводны. | Большинство не проводят электрический ток (проводниками являются, например, Si, графит). |
| Пластичность | Ковкие пластичные, тягучие. | В твердом состоянии хрупкие. |
| Температура плавления | От 3.380 0 С (W) до – 38,9 0 С (Hg) | От 3.800 0 С (графит) до – 210 0 С (N 2) |
| Вид химической связи | Металлическая | Ковалентная неполярная |
| Тип кристаллической решетки | Металлическая | Молекулярная |
По ходу заполнения таблицы учитель задает вопросы, отвечая на которые учащиеся заполняют таблицу.
Чем объясняются химические свойства металлов?
Какой тип связи для них характерен?
Записывается схема образования металлической связи на примере атома кальция, с ее занесением в таблицу.
Какой тип кристаллической решетки для них характерен?
Чем можно объяснить свойства неметаллов?
Какой тип связи характерен для неметаллов – простых веществ?
Записывается схема образования ковалентной неполярной связи на примере молекулы кислорода, с ее занесением в таблицу.
Какой тип кристаллической решетки характерен для неметаллов – простых веществ?
Для неметаллов характерно явление аллотропии.
Дать определение явлению аллотропии?
Приведите примеры аллотропных модификаций?
Например:
1. Кислород и озон, О 2 и О 3 , и рассмотрение их свойств.
2. Графит и алмаз.
Чем можно объяснить аллотропию?
1.Сроение кристаллической решетки.
2. Различным составом молекул.
Состав воздуха.
Озон – переменная составляющая воздуха. Еще в 18 веке Лавуазье установил, что воздух это не простое вещество, а смесь газов.
Сообщение на тему: «Состав воздуха».
Анализ и коррекция знаний.
Где в ПСХЭ Д.И. Менделеева располагаются неметаллы?
В чем особенность электронного строения неметаллов?
Дать определение Э.О.
Какие агрегатные состояния характерны для неметаллов?
Какай тип связи, характерен для неметаллов - простых веществ?
Какай тип кристаллической решетки, характерен для неметаллов?
Дать определение аллотропии.
Чем она объясняется?
На какие виды делятся компоненты воздуха?
V .Задание на дом.
П.25, задание 6 стр. 75 в учебнике.
Сообщение на тему:
Значение кислорода.
Виды загрязнений воздуха.
Тема: Химия неметаллов
Урок: Обобщение темы «Химия неметаллов»
Химические элементы-неметаллы.
Химические элементы, образующие простые вещества-неметаллы, располагаются в правом верхнем углу ПСХЭ Д.И. Менделеева. Таких химических элементов всего 16. Слева направо по периоду и снизу вверх по главной подгруппе радиусы атомов химических элементов уменьшаются, окислительные свойства и значения относительной электроотрицательности увеличиваются. Самый электроотрицательный элемент - фтор.
Особенностями строения атомов неметаллов по сравнению с металлами являются сравнительно небольшие атомные радиусы и большое число внешних электронов (как правило, 4 и более). Для большинства неметаллов будут более характерны окислительные свойства - им легче принимать электроны, чем отдавать.
Строение и физические свойства простых веществ-неметаллов.
Простых веществ-неметаллов больше, чем химических элементов-неметаллов. Это обусловлено явлением . Аллотропией называют способность атомов одного и того же химического элемента образовывать несколько простых веществ - аллотропных модификаций.
Например, химический элемент кислород образует две аллотропные модификации: кислород (необходимый для дыхания) и озон (защищающий Землю от УФ-лучей). Химический элемент сера образует три аллотропные модификации, самая устойчивая из которых при комнатной температуре - ромбическая сера. Известно несколько аллотропных модификаций углерода. Среди них алмаз, графит и фуллерен.
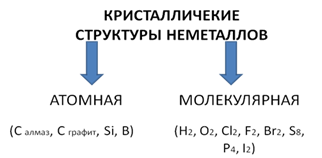
В простых веществах-неметаллах реализуется ковалентная неполярная химическая связь. Кристаллические структуры этих веществ могут быть атомными или молекулярными. Вещества с атомной кристаллической решеткой отличаются тугоплавкостью, твердостью, нелетучестью. Атомную кристаллическую решетку имеют кремний, алмаз, графит, бор. Вещества с молекулярной кристаллической решеткой легкоплавки и летучи. Во-первых, это газообразные при н. у. неметаллы (водород, кислород, хлор, фтор), единственный жидкий при н. у. неметалл - бром, твердые неметаллы (сера, белый фосфор, йод).
Общие химические свойства неметаллов.
Окислительные свойства неметаллов . В реакциях с металлами неметаллы всегда являются окислителями. При взаимодействии металлов с кислородом образуются, как правило, оксиды. Например, при горении магния в кислороде образуется оксид магния:

При взаимодействии металлов с галогенами образуются галогениды металлов. Например, при взаимодействии железа с хлором образуется хлорид железа(III):
![]()
При взаимодействии некоторых активных металлов с водородом образуются гидриды металлов. Например, при нагревании натрия с водородом образуется гидрид натрия:
![]()
При нагревании активных металлов с азотом (только литий реагирует с азотом без нагревания) образуются нитриды, в которых азот проявляет степень окисления -3. Например, при нагревании калия с азотом образуется нитрид калия:
![]()
Другие бинарные соединения металлов также образуются при взаимодействии металлов с соответствующими неметаллами. При нагревании железного и серного порошков образуется сульфид железа(II):
![]()
При взаимодействии магния с кремнием образуется силицид магния:
![]()
Неметаллы могут выступать в роли окислителей не только в реакциях с металлами, но и с другими неметаллами, значения относительной электроотрицательности которых будут ниже.
Например, при взаимодействии водорода с хлором водород проявляет восстановительные свойства, а хлор - окислительные:
![]()
При горении серы в кислороде: сера - восстановитель, кислород - окислитель:
![]()
Кислород и некоторые другие неметаллы могут выступать в роли окислителей и в реакциях со сложными веществами. Горение метана в кислороде:
Реакции замещения более активными галогенами менее активных в солях:
![]()
Восстановительные свойства неметаллов. Восстановительные свойства неметаллов проявляются в реакциях как с другими (более электроотрицательными) неметаллами, так и с некоторыми сложными веществами.
В реакциях с фтором все неметаллы проявляют восстановительные свойства. А с кислородом только фтор будет выступать в роли окислителя. При взаимодействии азота с кислородом под действием электрического разряда образуется монооксид азота. Азот в данном случае выступает в роли восстановителя:
![]()
При взаимодействии фосфора с избытком хлора образуется пентахлорид фосфора:
![]()
Сера проявляет восстановительные свойства, например, в реакции с концентрированной серной кислотой, в результате которой образуется сернистый газ и вода:
В составе серной кислоты сера - окислитель, а простое вещество сера - восстановитель.
1. Журин А. А. Задания и упражнения по химии: Дидактические материалы для учащихся 8-9 классов. - М.: Школьная Пресса, 2004.
2. Микитюк А. Д. Сборник задач и упражнений по химии. 8-11 классы / А. Д. Микитюк. - М.: Экзамен, 2009.
3. Оржековский П. А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. - М.: АСТ: Астрель, 2007.
4. Сборник задач и упражнений по химии: 9-й кл. / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. - М.: АСТ: Астрель, 2007.
5. Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. - М.: РИА «Новая волна»: Издатель Умеренков, 2008.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) ().
2. Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
Сборник задач и упражнений по химии: 9-й кл. / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. - М.: АСТ: Астрель, 2007. - с. 134-135 №№ 39, 40, 46; с. 121 № 492(б).











