Что такое свойство вещества в химии. Вещества и их свойства. Валентность. Составление химических формул
ХИМИЯ. ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА
Рассмотрим некоторые физические свойства вещества: агрегатное состояние, температуры плавления и кипения, кристаллическую структуру, электропроводность. Агрегатное состояние вещества определяется силой притяжения между составляющими его молекулами и температурой. В твердом теле молекулы достаточно сильно сцеплены друг с другом и их движение ограничивается колебаниями относительно фиксированных положений. С повышением температуры энергия молекул увеличивается, колебания становятся все более интенсивными, и в конце концов молекулы приобретают достаточно энергии, чтобы совершать поступательные движения. При этом твердое вещество плавится (если межмолекулярное взаимодействие остается достаточно сильным) или, сублимируясь, превращается в газ, молекулы которого движутся хаотически. Температура плавления (затвердевания) - это температура, при которой твердое вещество превращается в жидкость (или жидкость превращается в твердое вещество). Температура плавления воды равна 0° С (по шкале Цельсия) или 32° F (по шкале Фаренгейта). Поскольку при плавлении объем тела меняется незначительно, давление мало влияет на температуру плавления. Однако именно под действием высокого давления, оказываемого полозом конька, лед расплавляется, и спортсмен легко скользит по нему. Температура кипения - это температура, при которой жидкость превращается в пар (газ). Она зависит от давления, поэтому в горах вода кипит при более низкой температуре, чем на уровне моря. Температура кипения воды при давлении 760 мм рт. ст. ("стандартном" давлении, примерно равном давлению на уровне моря) составляет 100° С (или 212° F).
Кристаллические и аморфные вещества.
Твердые вещества бывают аморфными и кристаллическими. У аморфных молекулы расположены случайным образом. В качестве примера аморфного вещества можно привести стекло. Как и другие подобные вещества, стекло не имеет определенной температуры плавления: при нагревании оно постепенно размягчается, пока, наконец, не становится жидким. Напротив, молекулы (или ионы) кристаллических веществ расположены строго упорядоченно.
К кристаллическим веществам относятся песок, поваренная соль, сахар, алмаз, графит и т.п. Все они плавятся при определенной температуре (если только при нагревании не претерпевают никаких химических изменений, как это случается с сахаром). Многие ионные соединения (например, поваренная соль NaCl) образуют кристаллы, в которых каждый ион окружен противоположно заряженными ионами; в результате нельзя сказать, что какая-то конкретная пара ионов образует молекулу. Вследствие взаимного притяжения ионов в кристалле поваренной соли (NaCl) это вещество плавится при высокой температуре (801° С). Каждый ион NaCl окружен шестью ближайшими соседями, имеющими противоположный заряд. Элементарная ячейка кристалла поваренной соли - это куб, у которого по углам и в центре каждой грани расположены ионы натрия. Ячейка такого типа называется гранецентрированной кубической. Кубическую форму имеют и крупные кристаллы поваренной соли.
Кристаллическая решетка алмаза, в которой каждый атом углерода ковалентно связан с четырьмя соседними атомами, также характеризуется гранецентрированной кубической элементарной ячейкой. Алмаз - очень твердое вещество, имеющее высокую температуру перехода.
Типы химических реакций
Таким образом, стандартный килограмм определяется, а все остальные массы - это сравнение с этим килограммом. Когда массы атомов измеряются в масс-спектрометре, используется другой внутренний стандарт. Ваш урок урока в отношении массы состоит в том, что масса является относительным термином, судящим при сравнении.
Порядок составления химических формул
Объем - это мера объема пространства, занимаемого объектом. Объем можно измерять непосредственно с помощью оборудования, разработанного с использованием меток градуировки или косвенно, с использованием измерений длины в зависимости от состояния материала. Например, градуированный цилиндр представляет собой трубку, которая может содержать жидкость, которая помечена и помечена с регулярными интервалами, обычно каждые 1 или 10 мл. Как только жидкость помещается в цилиндр, можно прочитать градационные метки и записать измерение объема.

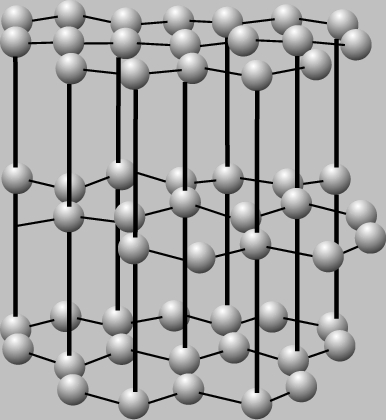
Совсем по-другому расположены атомы углерода в графите. Здесь они образуют слои, не очень прочно связанные друг с другом. Каждый слой "выстлан" шестиугольниками из углеродных атомов, аналогичными бензольному кольцу. Поскольку сцепление между слоями довольно слабое, графит мягкий. Слои легко скользят один относительно другого, благодаря чему графит является хорошим смазочным материалом. Разные кристаллические формы одного и того же элемента, такие, как графит и алмаз, называют аллотропами.
См. также АЛЛОТРОПИЯ .
Предмет химии. Вещества и их свойства
Поскольку объем изменяется с температурой, градуированное оборудование имеет пределы точности, с которой можно считывать измерения. Твердые объекты, имеющие правильную форму, могут рассчитывать объем, измеряя их размеры. В случае с коробкой его объем равен длине раз ширины по высоте.
Особенно интересно отметить, что измерение отличается от вычисления определенного значения. В то время как масса и объем могут определяться непосредственно по отношению к определенному стандарту или меткам линии на стекле, вычисление других значений из измерений не считается измерением. Например, как только вы сами измерили массу и объем жидкости, можно рассчитать плотность вещества, разделив массу на объем. Это считается косвенным определением плотности. Интересно, что можно также измерить плотность непосредственно, если настроен эксперимент, который позволяет сравнивать плотность со стандартом.
Вещества, молекулы которых удерживаются вместе слабыми силами притяжения, а не ковалентными или ионными связями, плавятся при относительно низких температурах, редко превышающих 400° С. Таково большинство органических соединений, а также ковалентные неорганические. В качестве примеров можно привести воду и бензол: температура их плавления значительно ниже комнатной.
Электропроводность. Металлы - прекрасные проводники электричества. Носителями электрического тока в них являются электроны, свободно "плавающие" в кристаллической решетке между ионами металла, занимающими фиксированное положение в узлах решетки. Эти электроны компенсируют взаимное отталкивание положительных ионов и стабилизируют всю структуру. Если к металлу приложить разность потенциалов, то электроны будут перемещаться к положительному полюсу и возникнет электрический ток.
Энциклопедия Кольера. - Открытое общество . 2000 .
Смотреть что такое "ХИМИЯ. ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА" в других словарях:
Вещества свойства, присущие веществу вне химического взаимодействия: температура плавления, температура кипения, вязкость, плотность, диэлектрическая проницаемость, теплоёмкость, теплопроводность, электропроводность, абсорбция, цвет, концентрация … Википедия
Другим количеством вещества, которое прямо или косвенно определено, является количество вещества. Это может представлять либо подсчитанное количество объектов, либо косвенно определенное количество частиц вещества, с которым приходится иметь дело, например, сколько атомов содержится в образце чистого вещества. Последнее количество описано в терминах молей. Один моль определенно определяется как количество частиц в 12 г изотопа углерода.
Основным строительным блоком материи является атом. Любой атом состоит из небольшого ядра, окруженного «облаком» электронов. В ядре есть протоны и нейтроны. Однако термин «атом» относится только к строительному блоку материи; он не определяет идентичность атома. Он может быть атомом углерода или атомом водорода или любым другим видом атома.
Физические свойства - – характеризуют какую либо особенность физического состояния или отношение материала к различным физическим процессам. Эта группа включает параметры состояния, гидрофизические и теплофизические свойства, радиационную стойкость. [ Косых, А.… … Энциклопедия терминов, определений и пояснений строительных материалов
Именно здесь вступает в действие термин «элемент». Когда атом определяется числом протонов, содержащихся в его ядре, химики ссылаются на него как на элемент. Все элементы имеют очень специфическую идентичность, которая делает их уникальными из других элементов. Например, атом с 6 протонами в его ядре известен как элементный углерод. Говоря об элементе фтора, химики означают атом, который содержит 9 протонов в своем ядре.
Элемент: однозначно идентифицируемый атом, определяемый числом протонов в ядре. . Несмотря на то, что мы определяем элемент как уникальный идентифицируемый атом, когда мы говорим, например, о 5 элементах, мы обычно не имеем в виду, что эти 5 атомов имеют один и тот же тип. Нет необходимости в 5 атомах. могут быть 10 или 100 и т.д. атомов, но эти атомы принадлежат одному из 5 типов атомов.
Наука о химических элементах, их соединениях и превращениях, происходящих в результате химических реакций. Она изучает, из каких веществ состоит тот или иной предмет; почему и как ржавеет железо, и почему олово не ржавеет; что происходит с пищей… … Энциклопедия Кольера
ХИМИЯ, отрасль науки, изучающая свойства, состав и структуру веществ и их взаимодействие друг с другом. В настоящее время химия представляет собой обширную область знаний и подразделяется прежде всего на органическую и неорганическую химию.… … Научно-технический энциклопедический словарь
Важно отметить, что если число протонов в ядре атома изменяется, то и тождество этого элемента. Если бы мы могли удалить протон из азота, это уже не азот. Фактически, мы должны идентифицировать атом как углерод. Помните, что элементы уникальны и всегда определяются количеством протонов в ядре. Периодическая таблица элементов показывает все известные элементы, организованные количеством протонов, которые у них есть.
Элемент состоит из одного и того же типа атома; элементный углерод содержит любое количество атомов, все из которых имеют 6 протонов в их ядрах. Напротив, соединения состоят из атомов разных типов. Точнее, соединение представляет собой химическое вещество, состоящее из двух или более элементов. Углеродное соединение содержит некоторые атомы углерода и некоторые другие атомы с различным числом протонов.
I Химия I. Предмет и структура химии Химия одна из отраслей естествознания, предметом изучения которой являются химические элементы (Атомы), образуемые ими простые и сложные вещества (молекулы (См. Молекула)), их превращения и… … Большая советская энциклопедия
У этого термина существуют и другие значения, см. Химия (значения). Химия (от араб. کيمياء, произошедшего, предположительно, от египетского слова km.t (чёрный), откуда возникло также название Египта, чернозёма и свинца «черная… … Википедия
Соединения имеют свойства, отличные от элементов, которые их создали. Вода, например, состоит из водорода и кислорода. Водород - взрывоопасный газ, а кислород - газ, который подпитывает огонь. Вода имеет совершенно разные свойства, будучи жидкостью, которая используется для тушения пожаров.
Наименьший представитель для соединения называется молекулой. Молекулы состоят из атомов, которые «связаны» вместе. Одним из важных физических свойств является состояние материи. Три обычны в повседневной жизни: твердые, жидкие и газообразные. Четвертая, плазма, наблюдается в особых условиях, например, в солнечных лучах и люминесцентных лампах. Вещества могут существовать в любом из состояний. Вода представляет собой соединение, которое может быть жидким, твердым или газообразным.
Первоначальное значение и происхождение этого слова неизвестно; возможно, что оно просто старое название северного Египта, и тогда наука Chemi значит египетская наука; но так как Chemi, кроме Египта, обозначало еще черный цвет, a μελάνοσις… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
- (ХПС) раздел органической химии, изучающий химические соединения, входящие в состав живых организмов, природные пути их превращений и методы искусственного получения. Как наука, химия природных соединений возникла одновременно с… … Википедия
Твердые тела имеют определенную форму и определенный объем. Большинство бытовых предметов - это твердые тела: скалы, стулья, лед и все, что имеет определенную форму и размер. Молекулы в твердом теле близки друг к другу и связаны межмолекулярными связями. Твердые вещества могут быть аморфными, что означает, что они не имеют определенной структуры или могут быть расположены в кристаллических структурах или сетях. Например, сажа, графит и алмаз сделаны из элементарного углерода, и все они являются твердыми.
Сажа аморфна, поэтому атомы случайно склеиваются. Графит образует параллельные слои, которые могут скользить друг мимо друга. Однако алмаз образует кристаллическую структуру, которая делает ее очень сильной. Жидкости имеют определенный объем, но они не имеют определенной формы. Вместо этого они принимают форму своего контейнера в той степени, в какой они действительно «содержатся» чем-то вроде мензурки или чашевидной руки или даже лужи. Если не «содержаться» на официальном или неофициальном судне, форма определяется другими внутренними и внешними силами.
Раздел физической химии, занимающийся изучением коллоидных дисперсных систем (дисперсий), в которых одно мелкораздробленное вещество дисперсная фаза равномерно распределено (диспергировано) в другой фазе дисперсионной среде. В коллоидных системах … Энциклопедия Кольера
Книги
- Химия. 10 (11) кл. Углубленный уровень. Тетрадь для практических работ. , Новошинский, Иван Иванович, Новошинская, Нина Степановна. Тетрадь для практических занятий поможет учащимся успешно выполнять практические работы по химии, на которых они будут получать вещества, изучать их свойства - физические и химические.…
Предмет химии. Вещества и их свойства.
Молекулы близки, но не так близко, как твердое тело. Межмолекулярные связи слабы, поэтому молекулы свободно проскальзывают друг мимо друга, плавно протекают. Свойством жидкостей является вязкость, мера «толщины» при протекании. Например, вода не такая вязкая, как меласса.
Газы не имеют определенного объема и не имеют определенной формы. Они расширяются, чтобы заполнить размер и форму их контейнера. Кислород, который мы дышим, и пар из горшка - оба примера газов. Молекулы очень далеки друг от друга в газе, и есть минимальные межмолекулярные силы. Каждый атом свободен двигаться в любом направлении. Газы подвергаются выпоту и диффузии. Эффузия происходит, когда газ просачивается через небольшое отверстие, и диффузия происходит, когда газ распространяется по комнате. Если кто-то оставляет на столе бутылку аммиака, и в ней есть дыра, в конечном итоге вся комната будет пахнуть газом аммиака.
Химия изучает вещества, их свойства и превращения.
Вещества - это то, из чего состоят тела. Они отличаются друг от друга физическими и химическими свойствами.
Валентность. Составление химических формул.
Валентность - это способность атомов химического элемента присоединять определенное число атомов другого элемента.
Это связано с диффузией и выпотом. Эти свойства газа происходят из-за того, что молекулы не связаны друг с другом. В газах межмолекулярные силы очень слабы, поэтому молекулы движутся случайным образом сталкиваясь с самим собой и со стенкой их контейнера, тем самым оказывая давление на их контейнер. Когда тепло выделяется газами, внутренняя молекулярная энергия уменьшается; в конечном счете, точка достигается, когда газ сжижается. Какие состояния могут иметь значение? Какие свойства имеет значение?
Какие типы материи существуют? Как меняется вопрос? - Это типичные вопросы, на которые может ответить химия. Из этих вопросов можно получить определение химии. Положим несколько лаконично, материя - это все, что требует пространства и имеет массу, где термин «масса» каким-либо образом связан с количеством рассматриваемой материи. Чтобы далее определить термин «вопрос», давайте обсудим несколько важных вопросов, связанных с вопросом.
Химическая формула - это условное обозначение состава вещества с помощью символов химических элементов и индексов.
Два правила по определению валентности:
1.Валентность металлов, находящихся в группе А (главная подгруппа) равна номеру группы.
2.Неметаллы проявляют в основном две валентности: высшую и низшую. Высшая (или максимальная) равна номеру группы. Низшая валентность равна разности между 8 и номером группы. (8 - №).
Таким образом, нет жидкого диоксида углерода при атмосферном давлении, увеличивается давление до по меньшей мере 2 бар, двуокись углерода также может возникать в жидкости. Физические свойства - это свойства, которые можно наблюдать без химического изменения рассматриваемого вещества. Примерами этого являются цвет, температура плавления, плотность, твердость, хрупкость и т.д.
В свою очередь, химические свойства - это те, которые описывают или предотвращают некоторые формы химических изменений. Например, образование ржавчины при воздействии влажного воздуха является химическим свойством железа - железа реагирует с составляющими воздуха с образованием нового вещества. Таким образом, железо обладает низкой коррозионной стойкостью. Напротив, золото обладает высокой коррозионной стойкостью. Другими примерами, в которых играют химические свойства, являются: растворимость алюминия в каустической соде, постепенное изменение цвета меди во влажном воздухе или сильная реакция натрия с водой.
Два правила по составлению химических формул:
1.При соединении металлов с неметаллами, последние проявляют низшую валентность.
2.При соединении неметаллов между собой, низшую валентность проявляет тот элемент, который находится в таблице Менделеева правее и выше, а высшую соответственно левее и ниже.
Порядок составления химических формул.
Химические элементы и соединения
В основном, химические свойства связаны с реакциями с другими веществами. Термин «физическое свойство» является спецификацией более общего свойства термина. Прежде всего, это измеримо и поэтому может быть описано в рамках возможной физической теории и наблюдаться в эксперименте. Поэтому в этих описаниях можно назначить размер физическим свойствам и назвать их.
Кроме того, физическое свойство может быть назначено либо на вещество, либо на случай аварии, при котором вещество неразрывно связано с самим объектом - неизменным образом бытия самой вещи. К ним относятся все неизменные свойства материи, такие как масса, заряд, спин, состав, но также генерируемые поля силы. С другой стороны, совпадение - это возможный способ бытия объекта, в современном использовании - состояние, которое было создано, например, путем вскрытия. Скорость, энергия, форма, намагниченность.
1.Находите приведенные элементы в таблице Менделеева:
Поочередно выписываем символы элементов, ставя на первое место элемент с высшей валентностью, соответственно на второе место - элемент с низшей валентностью.
2.Проставляем валентности, у элементов стоящих на первом месте - высшую (равную номеру группы), на втором месте - низшую (равную разности 8 - №). № - номер группы.
Помните, что фтор всегда проявляет низшую валентность равную единице.
3.Находите наименьшее общее кратное.
4.Делите наименьшее общее кратное на валентность каждого элемента и получаем соответствующий ему индекс.
5.Выписываете готовые формулы.
Типы химических реакций.
Химические реакции по количеству исходных веществ и продуктов реакции можно разделить на группы:
Реакции соединения - реакции между двумя простыми, или между несколькими сложными, при этом образуется одно сложное или более сложное вещество.
Реакции разложения - реакции, при которых из одного вещества образуется несколько простых или сложных веществ.
Реакции замещения - реакции между сложными и простыми веществами, при которых атомы простого вещества замещают один из атомов сложного.
Реакции обмена - реакции между двумя сложными веществами, при которых они обмениваются своими составными частями.
Главные характеристики элементов и их взаимосвязь со строением атомов.
1.Поряковый номер элемента - положительный заряд ядра, число протонов и общее число электронов.
2.Номер периода - число электронных слоев в атоме.
3.Номер группы - число электронов внешнего электронного слоя (для главных подгрупп), высшая валентность в кислородных соединениях.
Характеристику химического элемента составляют по плану:
1.химический знак и название элемента
2.положение химического элемента в Периодической системе Д.И.Менделеева (порядковый номер, номера периода и группы, главная или побочная подгруппа).
3.строение атома химического элемента (заряд ядра, число протонов, электронов и нейтронов, распределение электронов по энергетическим уровням).
4.свойства простого вещества, образованного атомами данного химического элемента (металл, амфотерный элемент, неметалл), валентность.
5.формула высшего оксида, соответствующего ему гидроксида, летучего водородного соединения, характер соединений с высшей валентностью элемента (основной, кислотный, амфотерный).
Обобщение сведений о строении электронных слоев в атомах химических элементов.
1.Электроны в электронной оболочке располагаются слоями. Первый от ядра слой завершен при наличии на нем двух электронов, второй - восьми.
2.Число электронных слоев в атоме совпадает с номером периода, в котором находится химический элемент. В этом заключается физический смысл номера периода в периодической системе.
3.На последнем уровне в атоме расположены электроны, которые слабо связаны с ядром, они более подвижны. Эти электроны называются «валентными», они определяют валентность элемента в соединении. У элементов, расположенных в одной группе, число валентных электронов одинаково и равно номеру группы. В этом состоит физический смысл номера группы.
4.Периодическое повторение свойств элементов объясняется периодическим появлением на внешнем энергетическом уровне одинакового числа электронов в их атомах.
Основные типы химической связи.
Ковалентная связь.
Химическая связь, образованная посредством общих электронных пар, называется ковалентной связью.
Различают ковалентную неполярную и ковалентную полярную связи:
Ковалентная связь, которая образована общей электронной парой, расположенной на равном расстоянии от ядер связываемых атомов, называется неполярной.
Ковалентная неполярная связь образуется между атомами, электроотрицательность которых одинакова, например при образовании простых веществ молекулы которых состоят из двух одинаковых атомов (это молекулы всех газов - водорода, фтора, хлора, кислорода, азота).
Ковалентная связь, которая образована общей электронной парой, смещенной в сторону ядра одного из связываемых атомов, называется полярной.
Ковалентная полярная связь образуется между атомами, электроотрицательность которых различна, характерна для соединений, образованных разными атомами (хлороводород, сероводород, аммиак).
Ионная связь.
Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются ионами.
Химическая связь, образованная за счет элетростатического притяжения ионов, называется ионной.
Характерна для соединений, образованных металлом и неметаллом, например - хлорид калия, фторид алюминия, гидрид лития.
Металлическая связь.
Металлической связью называется химическая связь, возникающая между атомами и положительными ионами металла и свободно движущимися между ними электронами.
Кристаллические решетки.
Кристаллические решетки веществ - это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решетки.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решёток: ионные, атомные, молекулярные, металлические. Рассмотрим каждую из решеток в отдельности и поподробней.
Ионные.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов.
Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Атомные.
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями.
В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз - самый твёрдый природный материал.
Молекулярные.
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные.
Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии.
Металлические.
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла.
Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электропроводность и теплопроводность.
Понятие о степени окисления. Вычисление степени окисления элементов по формуле вещества.
Степень окисления - это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (ионные и ковалентно-полярные) состоят только из ионов.
Правила вычисления степени окисления по химическим формулам.
1.В соединениях отрицательное значение степени окисления имеют элементы с большим значением элетроотрицательности, а положительное значение степени окисления - элементы с меньшим значением электроотрицательности.
2.Есть элементы с постоянной степенью окисления и элементы с переменной степенью окисления.
Элементы с постоянным значением степени окисления:
Металлы всегда имеют положительное значение степени окисления.
Элемент фтор в соединениях всегда имеет степень окисления -1
Элементы с переменным значением степени окисления:
Все остальные металлы (кроме металлов первой, второй, третьей групп главных подгрупп).
Почти все неметаллы.
Кислород почти всегда имеет степень окисления
Правила расстановки коэффициентов методом электронного баланса. 1. Расставить степени окисления.
2. Выписать элементы, изменившие степени окисления, указав число отданных и принятых электронов. Определить окислитель и восстановитель.
3. Поставить дополнительные коэффициенты, уравняв число отданных и принятых электронов.
4. Проверить эти коэффициенты: они должны соответствовать числу атомов данного элемента в молекуле. Например, если дополнительный коэффициент нечетный, а в молекуле четное число атомов (например, Сl 2), то оба дополнительных коэффициента удваиваются.
5. Проверенные коэффициенты переносят в уравнение к тем атомам, которые с данной степенью окисления встречаются в уравнении один раз.
6. Уравнивают атомы металлов; неметаллов; водорода.
7. Проверяют по кислороду.
