Fizička svojstva nemetala s primjerima. Nemetali. Opće karakteristike. Struktura atoma. Physical Properties
>> hemija: Jednostavne supstance- nemetali
nemetali - To su hemijski elementi koji u slobodnom obliku formiraju jednostavne supstance koje nemaju fizička svojstva metala. Od 109 hemijski elementi 87 su metali, 22 su nemetali.
6. Relativnost podjele prostih tvari na metale i nemetale.
Razmotrimo etimologiju imena pojedinih plemenitih metala.
Zašto je poetski izraz hemijski netačan: „U vazduhu je mirisalo na grmljavinu“?
Zapišite šeme za formiranje molekula: Na2, Br2, O2, N2. Koja je vrsta veze u ovim molekulima?
Sadržaj lekcije sažetak lekcije podrška okvir prezentacije lekcije akcelerativne metode interaktivne tehnologije Vježbajte zadaci i vježbe samoispitivanje radionice, treninzi, slučajevi, potrage domaća zadaća diskusija pitanja retorička pitanja učenika Ilustracije audio, video i multimedija fotografije, slike grafike, tabele, šeme humor, anegdote, vicevi, strip parabole, izreke, ukrštene reči, citati Dodaci sažetakačlanci čipovi za radoznale cheat sheets udžbenici osnovni i dodatni glosar pojmova ostalo Poboljšanje udžbenika i lekcijaispravljanje grešaka u udžbeniku ažuriranje fragmenta u udžbeniku elementi inovacije u lekciji zamjena zastarjelih znanja novim Samo za nastavnike savršene lekcije kalendarski plan za godinu metodološke preporuke programa diskusije Integrisane lekcijeNemetali su hemijski elementi koji u slobodnom obliku formiraju jednostavne supstance koje nemaju fizička svojstva metala. Od 114 hemijskih elemenata, 92 su metali, 22 su nemetali. Nemetali su jednostavne supstance, u normalnim uslovima mogu biti gasovi, tečnosti i čvrste materije (Sl. 46).
Rice. 46.
Jednostavne supstance - nemetali
Laboratorijski eksperiment br. 6
Upoznavanje sa kolekcijom nemetala
Istražite kolekciju nemetala. Zapišite hemijske formule nemetala koje su vam date, poredajte ih uzlaznim redoslijedom:
- gustina;
- tvrdoća;
- sijati;
- intenzitet promene boje.
Da biste izvršili zadatak, koristite dodatke 1 i 2, dodatne izvore informacija.
Gasovi su helijum He, neon Ne, argon Ar, kripton Kr, ksenon Xe, radon Rn. Zovu se inertni gasovi. Molekuli inertnog gasa sastoje se od jednog atoma. Na vanjskom elektronskom sloju atomi inertnih plinova (osim helijuma) imaju osam elektrona. Helijum ima dva. Po svojoj hemijskoj stabilnosti inertni gasovi podsećaju na plemenite metale - zlato i platinu, a imaju i drugo ime - plemeniti gasovi. Ovaj naziv je prikladniji za inertne plinove, koji ipak ponekad ulaze hemijske reakcije i formiraju jedinjenja. Godine 1962. pojavila se poruka da je dobijeno jedinjenje ksenona sa fluorom. Sada je poznato više od 150 jedinjenja ksenona, kriptona, radona sa fluorom, kiseonikom, hlorom i azotom.
Ideja o hemijskoj isključivosti plemenitih gasova pokazala se ne baš doslednom, pa su, umesto navodne nulte grupe, inertni gasovi stavljeni u grupu VIII (grupa VIIIA) tabele D. I. Mendeljejeva.
Helijum, koji je drugi po lakoći nakon vodonika, ali je, za razliku od potonjeg, nezapaljiv, odnosno ne predstavlja opasnost od požara, pun je balona i zračnih brodova (slika 47).

Rice. 47.
Baloni i vazdušni brodovi se pune helijumom
Neon se koristi za proizvodnju svjetleće reklame (Sl. 48). Setite se figurativnog izraza "ulice grada bile su preplavljene neonom".

Gasovi vodonik, kiseonik, azot, hlor, fluor formiraju dvoatomne molekule, odnosno - H 2 , O 2 , N 2 , Cl 2 , F 2 .
Sastav supstance je pismeno prikazan pomoću hemijskih znakova i brojeva - indeksa, koristeći hemijsku formulu. Prema hemijskoj formuli, kao što već znate, izračunava se relativna molekulska težina supstance (Mr). Relativna molekulska masa jednostavne tvari jednaka je umnošku relativne atomske mase na broj atoma u molekuli, na primjer kisik O 2:
Mr(02) = Ar(0) × 2 = 16 × 2 = 32.
Međutim, element kisik tvori još jednu plinovitu jednostavnu tvar - ozon, čije molekule već sadrže tri atoma kisika. Hemijska formula ozona je 0 3, a njegova relativna molekulska težina je: Mr(03) = 16 × 3 = 48.
Svojstva alotropskih modifikacija hemijskog elementa kiseonika - jednostavnih supstanci kiseonika O 2 i ozona O 3 - su različite. Kiseonik je bez mirisa, ali ozon miriše (otuda i njegovo ime - na grčkom ozon znači "miris"). Ovaj miris, aroma svježine, može se osjetiti za vrijeme grmljavine, jer ozon nastaje u malim količinama u zraku kao rezultat električnih pražnjenja.
Kiseonik je bezbojan gas, dok ozon ima blijedo ljubičastu boju. Ozon je baktericidniji (lat. qidao - ubijati) od kiseonika. Stoga se ozon koristi za dezinfekciju vode za piće. Ozon je u stanju da zadrži ultraljubičaste zrake Sunčevog spektra, koji su štetni za sav život na Zemlji, te stoga ozonski omotač, koji se nalazi u atmosferi na visini od 20-35 km, štiti život na našoj planeti (na slici 49. vidite fotografiju snimljenu iz svemira pomoću umjetnog satelita Zemlje gdje su područja niske razine ozona u atmosferi („ozonske rupe“) označena bijelom bojom).
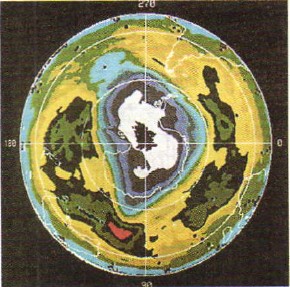
Rice. 49.
"Ozonske rupe" u Zemljinoj atmosferi
Od jednostavnih supstanci - nemetala u normalnim uslovima, samo je brom tečnost, čiji su molekuli dvoatomni. Formula broma je Br 2. To je teška smeđa tečnost neprijatnog mirisa (otuda i naziv, jer se bromos sa starogrčkog prevodi kao "smrdljiv").
Neke čvrste tvari - nemetali su poznate od davnina - to su sumpor i ugljik (u obliku drvenog uglja, dijamanta i grafita).
Kod čvrstih tijela - nemetala, također se opaža fenomen alotropije. Dakle, element ugljenik tvori tako jednostavne supstance, različite po izgledu, kao što su dijamant, grafit (Sl. 50). Razlog za razliku u svojstvima dijamanta i grafita je struktura kristalnih rešetki ovih supstanci, koju ćete razmotriti malo kasnije.
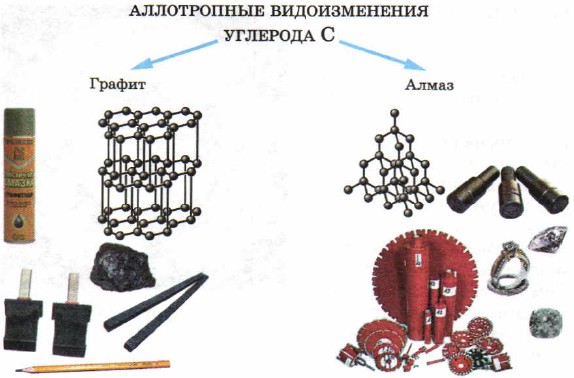
Rice. pedeset.
Alotropske modifikacije ugljika i njihova primjena
Element fosfor ima dvije alotropne modifikacije: crveni fosfor (prekrivaju stranu kutije šibica) i bijeli fosfor. Potonji ima molekulu od četiri atoma, njen sastav se odražava u formuli P 4 .
Čvrsta supstanca - nemetal je kristalni jod sa dvoatomskom molekulom I 2 . Nemojte ga brkati s alkoholnom otopinom joda - jodnom tinkturom koja je dostupna u svakom kućnom priboru prve pomoći.
Kristalni jod i grafit nisu kao druge jednostavne tvari - nemetali, imaju metalni sjaj.
Da bismo pokazali relativnost podjele jednostavnih supstanci na osnovu njihovih fizičkih svojstava na metale i nemetale, razmotrimo alotropiju hemijskog elementa kalaja Sn. Na sobnoj temperaturi obično postoji beta-kalaj (β-Sn). Ovo je dobro poznati bijeli kalaj - metal od kojeg su se lijevali limeni vojnici (sl. 51, a) (sjetite se bajke H. K. Andersena “Postojani limeni vojnik”). Sa unutrašnje strane limenih limenki obložen je lim (sl. 51, b). Dio je tako poznate legure kao što je bronza, kao i lem (slika 51, c).

Rice. 51.
Primjena kalaja:
a - igračke; b - proizvodnja konzervi; c - lem
Na temperaturama ispod +13,2 ° C, alfa-kalaj (α-Sn) je stabilniji - sivi sitnozrnati prah, koji radije ima svojstva nemetala. Proces pretvaranja bijelog lima u siv najbrži je na temperaturi od -33°C. Ova transformacija je dobila figurativni naziv "kalajna kuga".
Sada uporedimo jednostavne tvari - metale i nemetale koristeći tablicu 3.
Tabela 3
Jednostavne supstance

Ključne riječi i fraze
- plemenitih gasova.
- Alotropija i alotropske modifikacije ili modifikacije.
- kiseonik i ozon.
- Dijamant i grafit.
- Fosfor crveni i bijeli.
- Bijeli i sivi lim.
- Relativnost podjele jednostavnih supstanci na metale i nemetale.
Rad sa računarom
- Pogledajte elektronsku aplikaciju. Proučite materijal lekcije i dovršite predložene zadatke.
- Pretražujte na Internetu adrese e-pošte koje mogu poslužiti kao dodatni izvori koji otkrivaju sadržaj ključnih riječi i fraza pasusa. Ponudite učitelju svoju pomoć u pripremi nove lekcije – napravite izvještaj o ključnim riječima i frazama sljedećeg pasusa.
Pitanja i zadaci
- Razmotrite etimologiju imena pojedinih plemenitih plinova.
- Zašto je poetski izraz „U vazduhu je mirisao grmljavina“ hemijski netačan?
- Zapišite šeme za formiranje molekula: Na 2, Br 2, O 2, N 2. Koja je vrsta hemijske veze u ovim molekulima?
- Koja vrsta hemijske veze treba da bude u metalnom vodoniku?
- Ekspedicija polarnog istraživača R. Scotta na Južni pol 1912. godine propala je zbog činjenice da je izgubila cjelokupnu zalihu goriva: bilo je u rezervoarima zatvorenim limom. Koji hemijski proces stoji iza ovoga?
Predavanje 3. Nemetali
1. opšte karakteristike nemetalnih elemenata
Postoji samo 16 nemetalnih hemijskih elemenata, ali dva od njih, kiseonik i silicijum, čine 76% mase zemljine kore. Nemetali čine 98,5% mase biljaka i 97,6% mase čoveka. Ugljik, vodonik, kiseonik, sumpor, fosfor i azot su svi organska materija oni su elementi života. Vodik i helijum su glavni elementi svemira, svi svemirski objekti, uključujući naše Sunce, sastoje se od njih. Nemoguće je zamisliti naš život bez nemetalnih spojeva, pogotovo ako se prisjetimo da su vitalni hemijsko jedinjenje Voda se sastoji od vodonika i kiseonika.
Nemetali su hemijski elementi čiji atomi prihvataju elektrone da dovrše spoljašnji energetski nivo, formirajući tako negativno nabijene jone.
Gotovo svi nemetali imaju relativno male polumjere i veliki broj elektrona na vanjskom energetskom nivou od 4 do 7, odlikuju ih visoka elektronegativnost i oksidirajuća svojstva.
1.1. Položaj nemetalnih elemenata u periodnom sistemu hemijskih elemenata Mendeljejeva
Ako povučemo dijagonalu od bora do astatina u Periodnom sistemu, tada će se nemetalni elementi nalaziti prema gore na dijagonali desno, a metali dolje lijevo, tu spadaju i elementi svih bočnih podgrupa, lantanidi i aktinidi. Elementi koji se nalaze blizu dijagonale, na primjer, berilij, aluminij, titan, germanij, antimon, imaju dvostruki karakter i metaloidi su. Nemetalni elementi: s-element - vodonik; p-elementi grupe 13 - bor; 14 grupa - ugljenik i silicijum; Grupa 15 - azot, fosfor i arsen, grupa 16 - kiseonik, sumpor, selen i telur i svi elementi grupe 17 - fluor, hlor, brom, jod i astat. Elementi grupe 18 - inertni plinovi, zauzimaju poseban položaj, imaju potpuno završen vanjski elektronski sloj i zauzimaju srednji položaj između metala i nemetala. Ponekad se nazivaju i nemetali, ali formalno, prema fizičkim karakteristikama.
1.2. Elektronska struktura nemetalnih elemenata
Gotovo svi nemetalni elementi na vanjskom energetskom nivou imaju veliki broj elektrona - od 4 do 7. Element bor je analog aluminijuma, ima samo 3 elektrona na vanjskom energetskom nivou, ali ima mali radijus, čvrsto drži svoje elektrone i ima svojstva nemetala. Posebno zapazimo elektronsku strukturu vodonika. Ovo je element s, ali prilično lako prihvata jedan elektron, formira hidridni ion i pokazuje oksidirajuća svojstva metala.
Elektronske konfiguracije valentnih elektrona nemetalnih elemenata date su u tabeli:
1.3. Obrasci u promjeni svojstava nemetalnih elemenata
Razmotrimo neke obrasce u promjeni svojstava nemetalnih elemenata koji pripadaju istom periodu i istoj grupi na osnovu strukture njihovih atoma.
u periodu:
Nuklearni naboj se povećava
Radijus atoma se smanjuje
Povećava se broj elektrona na vanjskom energetskom nivou,
Povećava se elektronegativnost
Oksidirajuća svojstva su poboljšana,
Nemetalna svojstva su poboljšana.
u grupi:
Nuklearni naboj se povećava
Radijus atoma se povećava
Broj elektrona na vanjskom energetskom nivou se ne mijenja,
Elektronegativnost se smanjuje
Oksidirajuća svojstva su oslabljena,
Nemetalna svojstva su oslabljena.
Dakle, što je udesno i više element u periodnom sistemu, to su njegova nemetalna svojstva izraženija.
- ovo je sposobnost polarizacije hemijske veze, povlačenja zajedničkih elektronskih parova prema sebi.
22 elementa su klasifikovana kao nemetali.
Položaj nemetalnih elemenata u periodnom sistemu hemijskih elemenata
| Grupa | I | III | IV | V | VI | VII | VIII |
| 1. period | H | On | |||||
| 2. period | AT | OD | N | O | F | Ne | |
| 3. period | Si | P | S | CL | Ar | ||
| 4. period | As | Se | Br | kr | |||
| 5. period | Te | I | Xe | ||||
| 6. period | At | Rn |
Struktura atoma nemetala
Karakteristična karakteristika nemetala je veći (u poređenju sa metalima) broj elektrona na vanjskom energetskom nivou njihovih atoma. Ovo određuje njihovu veću sposobnost da dodaju dodatne elektrone i pokažu veću oksidativnu aktivnost od metala. Posebno jaka oksidaciona svojstva, odnosno sposobnost vezivanja elektrona, pokazuju nemetali koji se nalaze u 2. i 3. periodu grupa VI-VII. Ako uporedimo raspored elektrona u orbitalama u atomima fluora, hlora i drugih halogena, onda možemo suditi i o njihovim karakterističnim svojstvima. Atom fluora nema slobodne orbitale. Dakle, atomi fluora mogu pokazati samo valenciju I i oksidaciono stanje - 1. Najjači oksidant je fluor. U atomima drugih halogena, na primjer, u atomu hlora, postoje slobodne d-orbitale na istom energetskom nivou. Zbog toga se odvajanje elektrona može dogoditi na tri različita načina. U prvom slučaju, hlor može pokazati oksidaciono stanje +3 i formirati hlorovodoničnu kiselinu HClO 2 , što odgovara solima - hloritima, na primer kalijum hlorit KClO 2 . U drugom slučaju, hlor može formirati jedinjenja u kojima je oksidaciono stanje hlora +5. Takva jedinjenja uključuju kloridnu kiselinu HClO 3 i njene soli, hlorate, na primjer, kalijum hlorat KClO 3 (Bertoletova so). U trećem slučaju, hlor pokazuje oksidaciono stanje od +7, na primer, u perhlornoj kiselini HClO 4 iu njenim solima, perhloratima (u kalijum perhloratu KClO 4).Strukture molekula nemetala. Fizička svojstva nemetala
U gasovitom stanju na sobnoj temperaturi su:· vodonik - H 2 ;
· dušik, N 2 ;
· kiseonik - O 2 ;
· fluor - F 2 ;
· hlor - CI 2 .
I inertni gasovi:· helijum - He;
· neon - Ne;
· argon - Ar;
· kripton, Kr;
· ksenon - Xe;
· radon - Rn).
AT tečnost- brom - Br.AT solidan:
Telur - Te;
· jod - I;
· astatin - At.
Nemetali takođe imaju mnogo bogatiji spektar boja: crvena za fosfor, smeđa za brom, žuta za sumpor, žuto-zelena za hlor, ljubičasta za pare joda itd.Najtipičniji nemetali imaju molekularnu strukturu, dok oni manje tipični imaju nemolekularnu strukturu. Ovo objašnjava razliku u njihovim svojstvima.
Sastav i svojstva jednostavnih supstanci - nemetala
Nemetali formiraju i jednoatomne i dvoatomne molekule. To jednoatomski Nemetali uključuju inertne plinove koji praktički ne reagiraju čak ni s najaktivnijim tvarima. Inertni gasovi se nalaze u grupi VIII periodnog sistema, a hemijske formule odgovarajućih jednostavnih supstanci su sledeće: He, Ne, Ar, Kr, Xe i Rn.
Neki nemetali se formiraju dijatomski molekule. To su H 2, F 2, Cl 2, Br 2, Cl 2 (elementi VII grupe periodnog sistema), kao i kiseonik O 2 i azot N 2. Od triatomski molekule se sastoje od plina ozona (O 3). Za nemetalne supstance koje su u čvrstom stanju, prilično je teško napraviti hemijsku formulu. Atomi ugljika u grafitu povezani su jedni s drugima na različite načine. Teško je izolovati pojedinačni molekul u datim strukturama. Prilikom pisanja hemijske formule takve supstance, kao u slučaju metala, uvodi se pretpostavka da se takve supstance sastoje samo od atoma. Istovremeno, hemijske formule se pišu bez indeksa: C, Si, S, itd. Takve jednostavne supstance kao što su ozon i kiseonik, koje imaju isti kvalitativni sastav (oboje se sastoje od istog elementa - kiseonika), ali se razlikuju po broju atoma u molekulu imaju različita svojstva. Dakle, kiseonik nema miris, dok ozon ima oštar miris koji osećamo tokom grmljavine. Svojstva čvrstih nemetala, grafita i dijamanta, koji također imaju isti kvalitativni sastav, ali različitu strukturu, oštro se razlikuju (grafit je krhak, dijamant je tvrd). Dakle, svojstva tvari nisu određena samo njenim kvalitativnim sastavom, već i brojem atoma sadržanim u molekuli tvari i načinom na koji su međusobno povezani. Nemetali u obliku jednostavnih tijela nalaze se u čvrstom ili plinovitom stanju (isključujući brom - tečnost). Oni nemaju fizička svojstva metala. Čvrsti nemetali nemaju karakterističan sjaj metala, obično su krti, slabo provode struju i toplotu (osim grafita). Kristalni bor B (kao kristalni silicijum) ima vrlo visoku tačku topljenja (2075°C) i visoku tvrdoću. Električna provodljivost bora se uvelike povećava s povećanjem temperature, što omogućava njegovu široku primjenu u tehnologiji poluvodiča. Dodatak bora čeliku i legurama aluminijuma, bakra, nikla, itd. poboljšava njihova mehanička svojstva. Boridi (spoji bora s nekim metalima, na primjer, s titanom: TiB, TiB 2) su neophodni u proizvodnji dijelova mlaznih motora, lopatica gasnih turbina. Kao što se može vidjeti iz sheme 1, ugljenik je C, silicijum je Si, a bor je B imaju sličnu strukturu i imaju neka zajednička svojstva. Kao jednostavne tvari, javljaju se u dvije modifikacije - kristalnoj i amorfnoj. Kristalne modifikacije ovih elemenata su veoma tvrde, sa visokim tačkama topljenja. Kristalni silicijum ima svojstva poluprovodnika. Svi ovi elementi formiraju spojeve sa metalima - karbide, silicide i boride (CaC 2 , Al 4 C 3 , Fe 3 C, Mg 2 Si, TiB, TiB 2). Neki od njih imaju veću tvrdoću, kao što su Fe 3 C, TiB. Kalcijum karbid se koristi za proizvodnju acetilena.
