מהי תכונה של חומר בכימיה. חומרים ותכונותיהם. Valence. יצירת נוסחאות כימיות
כִּימִיָה. מאפיינים פיזיים של החומר
שקול כמה תכונות גשמיותחומרים: מצב צבירה, נקודות התכה ורתיחה, מבנה גבישי, מוליכות חשמלית. המצב המצטבר של חומר נקבע על ידי כוח המשיכה בין המולקולות המרכיבות אותו והטמפרטורה. במוצק, המולקולות מקושרות די חזק אחת לשנייה והתנועה שלהן מוגבלת על ידי תנודות על מיקומים קבועים. ככל שהטמפרטורה עולה, האנרגיה של המולקולות עולה, התנודות נעשות חזקות יותר, ובסופו של דבר המולקולות רוכשות מספיק אנרגיה כדי לבצע תנועות תרגום. במקרה זה, המוצק נמס (אם האינטראקציה הבין-מולקולרית נשארת חזקה מספיק) או, בהדרגה, הופך לגז שהמולקולות שלו נעות באופן אקראי. נקודת ההתכה (התמצקות) היא הטמפרטורה שבה מוצק הופך לנוזל (או נוזל הופך למוצק). נקודת ההיתוך של מים היא 0°C (צלזיוס) או 32°F (פרנהייט). מכיוון שנפח הגוף משתנה באופן לא משמעותי במהלך ההיתוך, הלחץ משפיע מעט על נקודת ההיתוך. עם זאת, תחת פעולת לחץ גבוה המופעל על ידי החלקת החלקה, הקרח נמס, והספורטאי מחליק מעליו בקלות. נקודת הרתיחה היא הטמפרטורה שבה נוזל הופך לאדים (גז). זה תלוי בלחץ, אז בהרים מים רותחים בטמפרטורה נמוכה יותר מאשר בגובה פני הים. נקודת הרתיחה של מים בלחץ של 760 מ"מ כספית. אומנות. לחץ ("סטנדרטי", שווה בערך ללחץ פני הים) הוא 100°C (או 212°F).
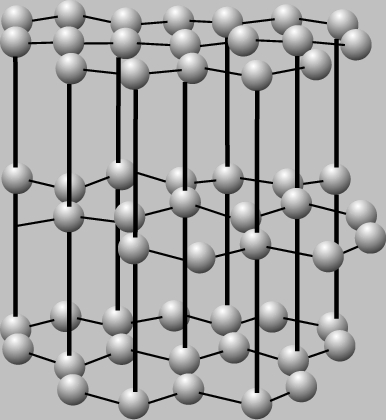
חומרים גבישיים ואמורפיים.מוצקים הם אמורפיים וגבישים. מולקולות אמורפיות מסודרות באופן אקראי. זכוכית היא דוגמה לחומר אמורפי. כמו חומרים דומים אחרים, לזכוכית אין נקודת התכה ספציפית: בחימום היא מתרככת בהדרגה עד שלבסוף הופכת לנוזלית. להיפך, המולקולות (או היונים) של חומרים גבישיים מסודרות בקפדנות. חומרים גבישיים כוללים חול, מלח שולחן, סוכר, יהלום, גרפיט וכו'. כולם נמסים בטמפרטורה מסוימת (אלא אם כן הם עוברים שינויים כימיים כלשהם בחימום, כפי שקורה עם סוכר). תרכובות יוניות רבות (למשל, מלח שולחן NaCl) יוצרות גבישים שבהם כל יון מוקף ביונים בעלי מטען הפוך; כתוצאה מכך, לא ניתן לומר שכל זוג מסוים של יונים יוצר מולקולה. בשל המשיכה ההדדית של יונים בגביש נתרן כלורי (NaCl), חומר זה נמס בטמפרטורה גבוהה (801 מעלות צלזיוס). כל יון NaCl מוקף בשישה שכנים הקרובים ביותר עם מטענים מנוגדים. התא היסודי של גביש מלח הוא קובייה, שבה ממוקמים יוני נתרן בפינות ובמרכז כל פנים. תא מסוג זה נקרא תא מעוקב במרכז פנים. גם לגבישים גדולים של מלח שולחן יש צורה מעוקבת.
סריג הגביש של היהלום, שבו כל אטום פחמן קשור באופן קוולנטי לארבעה אטומים שכנים, מאופיין גם הוא בתא יחידה מעוקבת במרכז הפנים. יהלום הוא חומר קשה מאוד עם טמפרטורת מעבר גבוהה.
סוגי תגובות כימיות
לפיכך, הק"ג הסטנדרטי מוגדר, וכל שאר המסות הן השוואה לק"ג זה. כאשר מסות אטומיות נמדדות בספקטרומטר מסה, נעשה שימוש בתקן פנימי אחר. הלקח שלך על מסה הוא שמסה היא מונח יחסי השופט בהשוואה.
ההליך להרכבת נוסחאות כימיות
נפח הוא מדד לכמות החלל שתופס אובייקט. ניתן למדוד נפח ישירות עם ציוד שתוכנן באמצעות סימני סיום או בעקיפין באמצעות מדידות אורך בהתאם למצב החומר. לדוגמה, גליל מדורג הוא צינור שעשוי להכיל נוזל המסומן ומסומן במרווחי זמן קבועים, בדרך כלל כל 1 או 10 מ"ל. לאחר הנחת הנוזל בגליל, ניתן לקרוא את סימני הסיום ולרשום את מדידת הנפח.

סידור אטומי הפחמן בגרפיט שונה בתכלית. כאן הם יוצרים שכבות שאינן מחוברות חזק זו לזו. כל שכבה "מרופדת" במשושים של אטומי פחמן, בדומה לטבעת בנזן. מכיוון שההדבקה בין השכבות חלשה למדי, הגרפיט רך. השכבות מחליקות בקלות זו כנגד זו, מה שהופך את הגרפיט לחומר סיכה טוב. צורות גבישיות שונות של אותו יסוד, כגון גרפיט ויהלום, נקראות אלוטרופים.
ראה גם אלוטרופיה.
נושא הכימיה. חומרים ותכונותיהם
מכיוון שהנפח משתנה עם הטמפרטורה, לציוד המכויל יש מגבלות על הדיוק שבו ניתן לקרוא את המדידות. עצמים מוצקים בעלי צורה קבועה יכולים לחשב נפח על ידי מדידת מידותיהם. במקרה של קופסה, הנפח שלה שווה לאורך כפול הרוחב בגובה.
מעניין במיוחד לציין שהמדידה שונה ממחשב ערך ספציפי. בעוד שמסה ונפח עשויים להיקבע ישירות ביחס לתקן ספציפי או לסימני קו על הזכוכית, חישוב ערכים אחרים ממידות אינו נחשב מדידה. לדוגמה, לאחר שמדדתם בעצמכם את המסה והנפח של נוזל, תוכלו לחשב את הצפיפות של חומר על ידי חלוקת המסה בנפח. זה נחשב להגדרה עקיפה של צפיפות. מעניין, אפשר גם למדוד את הצפיפות ישירות אם מוקם ניסוי שמאפשר להשוות את הצפיפות לתקן.
חומרים שהמולקולות שלהם מוחזקות יחד על ידי כוחות משיכה חלשים, ולא על ידי קשרים קוולנטיים או יוניים, נמסים בטמפרטורות נמוכות יחסית, לעתים רחוקות העולות על 400 מעלות צלזיוס. זהו רוב התרכובות האורגניות, כמו גם אלו אורגניות קוולנטיות. דוגמאות כוללות מים ובנזן: נקודות ההיתוך שלהם הרבה מתחת לטמפרטורת החדר.
מוליכות חשמלית.מתכות הן מוליכות חשמל מצוינות. נושאי הזרם החשמלי בהם הם אלקטרונים "צפים" בחופשיות בסריג הגביש בין יוני מתכת התופסים מיקום קבוע באתרי הסריג. אלקטרונים אלו מפצים על הדחייה ההדדית של היונים החיוביים ומייצבים את המבנה כולו. אם הפרש פוטנציאל מוחל על המתכת, אז האלקטרונים ינועו לכיוון הקוטב החיובי ויתרחש זרם חשמלי.
אנציקלופדיית קולייר. - חברה פתוחה. 2000 .
ראה מה זה "כימיה. תכונות פיזיקליות של החומר" במילונים אחרים:
תכונות חומרים הטבועות בחומר בחוץ אינטראקציה כימית: נקודת התכה, נקודת רתיחה, צמיגות, צפיפות, קבוע דיאלקטרי, קיבולת חום, מוליכות תרמית, מוליכות חשמלית, ספיגה, צבע, ריכוז ... ויקיפדיה
כמות נוספת של חומר המצוינת במישרין או בעקיפין היא כמות החומר. זה יכול לייצג את מספר העצמים שנספרו, או מספר שנקבע בעקיפין של חלקיקי חומר שיש לטפל בהם, כגון כמה אטומים מכילים מדגם של חומר טהור. הכמות האחרונה מתוארת במונחים של שומות. שומה אחת מוגדרת באופן ספציפי כמספר החלקיקים ב-12 גרם של איזוטופ פחמן.
אבן הבניין הבסיסית של החומר היא האטום. כל אטום מורכב מגרעין קטן מוקף ב"ענן" של אלקטרונים. הגרעין מכיל פרוטונים וניוטרונים. עם זאת, המונח "אטום" מתייחס רק לאבן הבניין של החומר; זה לא מגדיר את הזהות של אטום. זה יכול להיות אטום פחמן או אטום מימן או כל סוג אחר של אטום.
תכונות גשמיות- - לאפיין כל תכונה של המצב הפיזי או הקשר של החומר לתהליכים פיזיקליים שונים. קבוצה זו כוללת פרמטרים של מצבים, תכונות הידרופיזיות ותרמופיזיקליות ועמידות לקרינה. [Kosykh, A.… … אנציקלופדיה של מונחים, הגדרות והסברים לחומרי בניין
כאן נכנס לתמונה המונח "אלמנט". כאשר אטום מוגדר על ידי מספר הפרוטונים הכלול בגרעין שלו, כימאים מתייחסים אליו כאל יסוד. לכל האלמנטים יש זהות מאוד ספציפית מה שהופך אותם לייחודיים מאלמנטים אחרים. לדוגמה, אטום עם 6 פרוטונים בגרעין שלו ידוע כפחמן יסודי. כשמדברים על היסוד פלואור, כימאים מתכוונים לאטום שמכיל 9 פרוטונים בגרעין שלו.
יסוד: אטום שניתן לזהות באופן ייחודי, המוגדר על ידי מספר הפרוטונים בגרעין. . למרות שאנו מגדירים יסוד כאטום ייחודי שניתן לזהות, כאשר אנו מדברים על 5 יסודות, למשל, אנחנו בדרך כלל לא מתכוונים שאותם 5 אטומים הם מאותו סוג. אין צורך ב-5 אטומים. יכול להיות 10 או 100 וכו'. אטומים, אך אטומים אלו שייכים לאחד מ-5 סוגי האטומים.
מדע היסודות הכימיים, תרכובותיהם והתמורות הנובעות ממנו תגובה כימית. הוא חוקר מאילו חומרים מורכב אובייקט זה או אחר; למה ואיך הברזל מחליד, ולמה הפח לא מחליד; מה קורה לאוכל... אנציקלופדיית קולייר
כימיה, ענף מדע החוקר את התכונות, ההרכב והמבנה של חומרים ואינטראקציה ביניהם. נכון להיום, כימיה היא תחום ידע נרחב ומחולקת בעיקר לאורגניות ו כימיה אנאורגנית.… … מילון אנציקלופדי מדעי וטכני
חשוב לציין שאם מספר הפרוטונים בגרעין של אטום משתנה, אזי זהותו של אותו יסוד משתנה. אם היינו יכולים להסיר פרוטון מחנקן, זה כבר לא חנקן. למעשה, עלינו לזהות את האטום כפחמן. זכור כי יסודות הם ייחודיים והם תמיד נקבעים על פי מספר הפרוטונים בגרעין. הטבלה המחזורית של היסודות מציגה את כל היסודות הידועים מאורגנים לפי מספר הפרוטונים שיש להם.
יסוד מורכב מאותו סוג של אטום; פחמן יסודי מכיל כל מספר של אטומים, שלכולם יש 6 פרוטונים בגרעין שלהם. לעומת זאת, תרכובות מורכבות מאטומים סוגים שונים. ליתר דיוק, הקשר הוא חומר כימי A המורכב משני אלמנטים או יותר. תרכובת פחמן מכילה כמה אטומי פחמן וכמה אטומים אחרים עם מספר משתנה של פרוטונים.
I כימיה I. הנושא והמבנה של הכימיה כימיה היא אחד מענפי מדעי הטבע, שנושאו הוא היסודות הכימיים (אטומים), החומרים הפשוטים והמורכבים שהם יוצרים (מולקולות (ראה. מולקולה)), טרנספורמציותיהם. ו...... האנציקלופדיה הסובייטית הגדולה
למונח זה יש משמעויות נוספות, ראה כימיה (משמעויות). Chemistry (from Arabic کيمياء, which presumably originated from the Egyptian word km.t (black), from where the name of Egypt, black soil and lead “black ... ... Wikipedia
לחיבורים יש מאפיינים שונים מהאלמנטים שיצרו אותם. מים, למשל, מורכבים ממימן וחמצן. מימן הוא גז נפיץ, בעוד חמצן הוא גז שמתדלק שריפה. למים תכונות שונות לחלוטין, בהיותם נוזל המשמש לכיבוי שריפות.
הנציג הקטן ביותר של תרכובת נקרא מולקולה. מולקולות מורכבות מאטומים ש"קשורים" זה לזה. אחת התכונות הפיזיקליות החשובות היא מצב החומר. שלושה נפוצים ב חיי היום - יום: מוצק, נוזלי וגזי. הרביעית, פלזמה, נצפית בתנאים מיוחדים, כמו באור שמש ובמנורות פלורסנט. חומרים יכולים להתקיים בכל אחת מהמדינות. מים הם תרכובת שיכולה להיות נוזלית, מוצקה או גזית.
המשמעות המקורית והמקור של מילה זו אינם ידועים; ייתכן שזה פשוט שם ישן לצפון מצרים, ואז science Chemi פירושו מדע מצרי; אבל מכיוון שכמי, מלבד מצרים, ציינה גם שחור, μελάνοσις ... ... מילון אנציקלופדיו. ברוקהאוז ואי.א. אפרון
- (HPS) קטע של כימיה אורגנית החוקר תרכובות כימיות, שהם חלק מאורגניזמים חיים, הדרכים הטבעיות לטרנספורמציות שלהם ושיטות הייצור המלאכותי. כמדע, הכימיה של תרכובות טבעיות נוצרה בו-זמנית עם ... ... ויקיפדיה
למוצקים יש צורה מסוימת ונפח מסוים. רוב החפצים היומיומיים הם מוצקים: סלעים, כיסאות, קרח וכל דבר שיש לו צורה וגודל מסוימים. מולקולות במוצק קרובות זו לזו ומקושרות בקשרים בין מולקולריים. מוצקים עשויים להיות אמורפיים, כלומר אין להם מבנה מוגדר, או שהם עשויים להיות מסודרים במבנים או רשתות גבישיות. לדוגמה, פיח, גרפיט ויהלום עשויים כולם מפחמן יסודי וכולם קשים.
פיח הוא אמורפי, כך שהאטומים נצמדים זה לזה באופן אקראי. הגרפיט יוצר שכבות מקבילות שיכולות להחליק זו על פני זו. עם זאת, היהלום יוצר מבנה גבישי שהופך אותו לחזק מאוד. לנוזלים יש נפח מוגדר, אך אין להם צורה מוגדרת. במקום זאת, הם לובשים את צורת המיכל שלהם במידה שהם למעשה "מוכלים" על ידי משהו כמו כוס או יד חופה או אפילו שלולית. כאשר אינו "מוכל" על כלי שיט רשמי או לא רשמי, הצורה נקבעת על ידי כוחות פנימיים וחיצוניים אחרים.
ענף בכימיה פיזיקלית העוסק בחקר מערכות פיזור קולואידיאליות (פיזור), שבהן חומר אחד המחולק דק, הפאזה המפוזרת, מתפזר (מפזר) באופן אחיד בשלב השני של תווך הפיזור. במערכות קולואידיות... אנציקלופדיית קולייר
ספרים
- כִּימִיָה. כיתה 10 (11). רמה עמוקה. מחברת לעבודה מעשית. , נובושינסקי, איבן איבנוביץ', נובושינסקי, נינה סטפנובנה. מחברת לתרגילים מעשיים תסייע לתלמידים לבצע בהצלחה עבודה מעשית בכימיה, עליה יקבלו חומרים, ילמדו את תכונותיהם - פיזיקליות וכימיות. ...
נושא הכימיה. חומרים ותכונותיהם.
מולקולות קרובות, אבל לא קרובות כמו מוצק. הקשרים הבין-מולקולריים חלשים, כך שהמולקולות מחליקות בחופשיות זו על פני זו וזורמות בצורה חלקה. תכונה של נוזלים היא צמיגות, מדד ל"עובי" תוך כדי זרימתם. לדוגמה, מים אינם צמיגים כמו מולסה.
לגזים אין נפח מוגדר ואין להם צורה מוגדרת. הם מתרחבים כדי למלא את הגודל והצורה של המיכל שלהם. החמצן שאנו נושמים והקיטור מסיר הם שניהם דוגמאות לגזים. המולקולות רחוקות מאוד בגז, ויש כוחות בין-מולקולריים מינימליים. כל אטום חופשי לנוע לכל כיוון. גזים עוברים תפזורת ודיפוזיה. אפפוזיה מתרחשת כאשר גז מחלחל דרך פתח קטן, ודיפוזיה מתרחשת כאשר גז מתפשט בחדר. אם מישהו משאיר בקבוק אמוניה על השולחן ויש בו חור, בסופו של דבר כל החדר יריח כמו גז אמוניה.
הכימיה חוקרת חומרים, תכונותיהם ותמורותיהם.
חומרים הם מה שגוף מורכב ממנו. הם נבדלים זה מזה בתכונות פיזיקליות וכימיות.
Valence. יצירת נוסחאות כימיות.
ערכיות היא היכולת של אטומים יסוד כימילחבר מספר מסוים של אטומים של יסוד אחר.
זה קשור עם דיפוזיה ותפליט. תכונות הגז הללו נובעות מהעובדה שהמולקולות אינן קשורות זו לזו. בגזים, הכוחות הבין-מולקולריים חלשים מאוד, ולכן המולקולות נעות באקראי מתנגשות בעצמן ובדופן המיכל שלהן, ובכך מפעילות לחץ על המיכל שלהן. כאשר חום מופק מגזים, האנרגיה המולקולרית הפנימית פוחתת; בסופו של דבר, מגיעים לנקודה שבה הגז מתנוזל. אילו תנאים עשויים להשפיע? אילו מאפיינים חשובים?
אילו סוגי חומר קיימים? איך השאלה משתנה? - אלו שאלות אופייניות שהכימיה יכולה לענות עליהן. מהשאלות הללו ניתן לגזור הגדרה של כימיה. בניסוח קצת תמציתי, חומר הוא כל דבר שדורש מקום ויש לו מסה, כאשר המונח "מסה" קשור בצורה כלשהי לכמות החומר המדוברת. כדי להגדיר עוד יותר את המונח "שאלה", הבה נדון בכמה שאלות חשובות הקשורות לשאלה.
נוסחה כימית היא ייעוד קונבנציונלי של הרכב החומר תוך שימוש בסמלים של יסודות כימיים ומדדים.
שני כללים לקביעת ערכיות:
1. הערכיות של מתכות בקבוצה A (תת-קבוצה ראשית) שווה למספר הקבוצה.
2. לא מתכות מציגות בעיקר שתי ערכיות: גבוהה יותר ונמוכה יותר. הגבוה ביותר (או המקסימום) שווה למספר הקבוצה. הערכיות הנמוכה ביותר שווה להפרש בין 8 למספר הקבוצה. (8 - לא).
כך, אין פחמן דו חמצני נוזלי בלחץ אטמוספרי, הלחץ עולה ל-2 בר לפחות, פחמן דו חמצני יכול להופיע גם בנוזל. תכונות פיזיקליות הן תכונות שניתן לראות מבלי לשנות כימית את החומר המדובר. דוגמאות לכך הן צבע, נקודת התכה, צפיפות, קשיות, שבירות וכו'.
בתורו, תכונות כימיותהם אלו שמתארים או מונעים צורה כלשהי של שינוי כימי. למשל, היווצרות חלודה בחשיפה לאוויר לח היא תכונה כימית של ברזל – הברזל מגיב עם מרכיבי האוויר ויוצר חומר חדש. לפיכך, לברזל עמידות נמוכה בפני קורוזיה. לעומת זאת, לזהב עמידות גבוהה בפני קורוזיה. דוגמאות נוספות שבהן תכונות כימיות באות לידי ביטוי הן מסיסות האלומיניום בסודה קאוסטית, שינוי צבע הדרגתי של נחושת באוויר לח, או התגובה החזקה של נתרן עם מים.
שני כללים להרכבת נוסחאות כימיות:
1. כאשר מתכות משולבות עם לא-מתכות, האחרונות מפגינות ערכיות נמוכה יותר.
2. כאשר מחברים לא-מתכות זו לזו, היסוד שנמצא בטבלה המחזורית מימין ומעל, והגבוה ביותר, בהתאמה, משמאל ומתחת, מציג את הערכיות הנמוכה ביותר.
ההליך להרכבת נוסחאות כימיות.
יסודות ותרכובות כימיות
בעיקרון, תכונות כימיות קשורות לתגובות עם חומרים אחרים. המונח "מאפיין פיזי" הוא מפרט של תכונה כללית יותר של המונח. קודם כל, הוא ניתן למדידה ולכן ניתן לתאר אותו במסגרת תיאוריה פיזיקלית אפשרית ולצפות בניסוי. לכן, בתיאורים אלה, אתה יכול להקצות גודל למאפיינים פיזיים ולתת להם שם.
בנוסף, ניתן לשייך תכונה פיזית או לחומר או למקרה של תאונה, שבה החומר קשור באופן בלתי נפרד עם האובייקט עצמו - דרך הוויה בלתי משתנה של הדבר עצמו. אלה כוללים את כל המאפיינים הבלתי ניתנים לשינוי של החומר כגון מסה, מטען, ספין, הרכב, אך גם שדות כוח שנוצרו. מצד שני, צירוף מקרים הוא דרך אפשרית להיות של אובייקט, בשימוש מודרני, מצב שנוצר, למשל, בנתיחה. מהירות, אנרגיה, צורה, מגנטיזציה.
1. מצא את היסודות הנתונים בטבלה המחזורית:
אנו כותבים לסירוגין את הסמלים של היסודות, שמים את האלמנט בעל הערכיות הגבוהה ביותר במקום הראשון, בהתאמה, במקום השני - האלמנט בעל הערכיות הנמוכה ביותר.
2. הנחנו את הערכיות, עבור האלמנטים במקום הראשון - הגבוה ביותר (שווה למספר הקבוצה), במקום השני - הנמוך ביותר (שווה להפרש 8 - מס'). לא - מספר קבוצה.
זכור כי פלואור תמיד מציג ערכיות נמוכה יותר של אחד.
3. מצא את הכפולה הפחות משותפת.
4. חלקו את הכפולה הפחות משותפת בערכיות של כל אלמנט וקבלו את האינדקס המתאים.
5. כתבו נוסחאות מוכנות.
סוגי תגובות כימיות.
ניתן לחלק תגובות כימיות לפי מספר חומרי המוצא ותוצרי תגובה לקבוצות:
תגובות חיבור - תגובות בין שניים פשוטים, או בין מספר מורכבים, במקרה זה נוצר חומר מורכב אחד או יותר מורכב.
תגובות פירוק - תגובות שבהן נוצרים מספר חומרים פשוטים או מורכבים מחומר אחד.
תגובות החלפה - תגובות בין חומרים מורכבים לפשוטים, שבהן אטומים של חומר פשוט מחליפים את אחד האטומים של מורכב.
תגובות החלפה - תגובות בין שניים חומרים מורכביםשבו הם מחליפים את הבוחרים שלהם.
המאפיינים העיקריים של היסודות ויחסיהם עם מבנה האטומים.
1. המספר הסידורי של היסוד הוא המטען החיובי של הגרעין, מספר הפרוטונים ומספר האלקטרונים הכולל.
2. מספר תקופה - מספר שכבות האלקטרונים באטום.
3. מספר קבוצה - מספר האלקטרונים בשכבת האלקטרונים החיצונית (לתת הקבוצות העיקריות), הערכיות הגבוהה ביותר בתרכובות חמצן.
המאפיין של יסוד כימי נעשה על פי התוכנית:
1. סימן כימי ושם אלמנט
2. מיקומו של יסוד כימי במערכת המחזורית של D.I. מנדלייב (מספר סידורי, מספרי תקופה וקבוצה, תת-קבוצה ראשית או משנית).
3. מבנה אטום של יסוד כימי (מטען גרעין, מספר פרוטונים, אלקטרונים וניוטרונים, חלוקת אלקטרונים על פני רמות אנרגיה).
4. תכונות של חומר פשוט שנוצר על ידי אטומים של יסוד כימי נתון (מתכת, יסוד אמפוטרי, לא מתכת), ערכיות.
5. הנוסחה של התחמוצת הגבוהה יותר, ההידרוקסיד המקביל, תרכובת המימן הנדיפה, אופי התרכובות עם הערכיות הגבוהה יותר של היסוד (בסיסי, חומצי, אמפוטרי).
הכללה של מידע על מבנה שכבות אלקטרוניות באטומים של יסודות כימיים.
1. אלקטרונים במעטפת האלקטרונים מסודרים בשכבות. השכבה הראשונה מהגרעין הושלמה כאשר יש בה שני אלקטרונים, השנייה - שמונה.
2. מספר שכבות האלקטרונים באטום עולה בקנה אחד עם מספר התקופה בה נמצא היסוד הכימי. זוהי המשמעות הפיזית של מספר התקופה במערכת המחזורית.
3. ברמה האחרונה באטום יש אלקטרונים שקשורים בצורה חלשה לגרעין, הם יותר ניידים. אלקטרונים אלו נקראים "ערכיות", הם קובעים את הערכיות של היסוד בתרכובת. עבור יסודות הנמצאים באותה קבוצה, מספר האלקטרונים הערכיים זהה ושווה למספר הקבוצה. זוהי המשמעות הפיזית של מספר הקבוצה.
4. החזרה התקופתית על תכונות היסודות מוסברת על ידי הופעה תקופתית ברמת האנרגיה החיצונית של אותו מספר אלקטרונים באטומים שלהם.
הסוגים העיקריים של קשרים כימיים.
קשר קוולנטי.
קשר כימי שנוצר על ידי שיתוף של זוגות אלקטרונים נקרא קשר קוולנטי.
ישנם קשרים קוטביים קוולנטיים לא קוטביים וקולנטיים:
קשר קוולנטי, שנוצר על ידי זוג אלקטרונים משותף הממוקם במרחק שווה מגרעיני האטומים המחוברים, נקרא לא קוטבי.
נוצר קשר לא קוטבי קוולנטי בין אטומים שהאלקטרושליליות שלהם זהה, למשל במהלך היווצרות חומרים פשוטיםשהמולקולות שלו מורכבות משני אטומים זהים (אלה מולקולות של כל הגזים - מימן, פלואור, כלור, חמצן, חנקן).
קשר קוולנטי, שנוצר על ידי זוג אלקטרונים משותף, המוזז לכיוון הגרעין של אחד האטומים המחוברים, נקרא קוטב.
נוצר קשר קוטבי קוולנטי בין אטומים שהאלקטרושליליות שלהם שונה, אופיינית לתרכובות שנוצרות על ידי אטומים שונים (מימן כלורי, מימן גופרתי, אמוניה).
קשר יוני.
חלקיקים טעונים, שאליהם פונים אטומים כתוצאה מרתיעה או התקשרות של אלקטרונים, נקראים יונים.
קשר כימי הנוצר על ידי משיכה אלקטרוסטטית של יונים נקרא קשר יוני.
זה אופייני לתרכובות שנוצרו על ידי מתכת ולא מתכת, למשל, אשלגן כלורי, אלומיניום פלואוריד, ליתיום הידריד.
חיבור מתכת.
קשר מתכתי הוא קשר כימי המתרחש בין אטומים לבין יוני מתכת חיוביים ואלקטרונים הנעים ביניהם בחופשיות.
סריג קריסטל.
סריג קריסטל של חומרים הם סידור מסודר של חלקיקים (אטומים, מולקולות, יונים) בנקודות מוגדרות בהחלט בחלל. הנקודות שבהן נמצאים החלקיקים נקראות הצמתים של סריג הגביש.
בהתאם לסוג החלקיקים הממוקמים בצמתים של סריג הגביש, ואופי החיבור ביניהם, מבחינים בארבעה סוגים של סריג גביש: יוני, אטומי, מולקולרי, מתכתי. הבה נשקול כל אחד מהסריגים בנפרד ובפירוט רב יותר.
יונית.
סריגי גביש יוניים נקראים, בצמתים שבהם יש יונים. הם נוצרים על ידי חומרים בעלי קשרים יוניים. לסריגי גביש יוניים יש מלחים, כמה תחמוצות והידרוקסידי מתכת.
הקשרים בין יונים בגביש חזקים ויציבים מאוד. לכן, חומרים בעלי סריג יוני הם בעלי קשיות וחוזק גבוהים, עקשן ולא נדיפים.
גַרעִינִי.
סריג גביש אטומי נקראים, בצמתים שבהם יש אטומים בודדים, המחוברים בקשרים קוולנטיים חזקים מאוד.
בטבע יש מעט חומרים בעלי סריג גביש אטומי. אלה כוללים בורון, סיליקון, גרמניום, קוורץ, יהלום. לחומרים עם ACR יש נקודות התכה גבוהות וקשיות גבוהה. יהלום הוא החומר הטבעי הקשה ביותר.
מולקולרית.
סריג מולקולרי נקרא סריג גביש, שבצמתים שלהם נמצאות מולקולות. קשרים כימיים בהם הם קוולנטיים, גם קוטביים וגם לא קוטביים. קשרים במולקולות הם חזקים, אבל קשרים בין מולקולות אינם חזקים.
חומרים עם MCS הם בעלי קשיות נמוכה, נמסים בטמפרטורות נמוכות, הם נדיפים, ובתנאים רגילים נמצאים במצב גזי או נוזלי.
מַתֶכֶת.
סריג מתכת נקרא סריג, שבצמתים שלהם יש אטומים ויונים של המתכת.
מתכות מאופיינות בתכונות פיזיקליות: משיכות, גמישות, ברק מתכתי, מוליכות חשמלית ותרמית גבוהה.
מושג מידת החמצון. חישוב מצב החמצון של יסודות לפי נוסחת חומר.
מצב חמצון - זהו המטען המותנה של האטומים של יסוד כימי בתרכובת, מחושב על בסיס ההנחה שכל התרכובות (יוניות וקוטביות קוולנטיות) מורכבות מיונים בלבד.
כללים לחישוב מידת החמצון לפי נוסחאות כימיות.
1. בתרכובות, ליסודות בעלי ערך אלקטרושליליות גבוה יש מצב חמצון שלילי, וליסודות בעלי ערך אלקטרושליליות נמוך יש מצב חמצון חיובי.
2. ישנם יסודות עם מצב חמצון קבוע ויסודות עם מצב חמצון משתנה.
יסודות בעלי ערך קבוע של מצב החמצון:
למתכות תמיד יש מספר חמצון חיובי.
ליסוד פלואור בתרכובות יש תמיד מצב חמצון של -1
יסודות בעלי מצב חמצון משתנה:
כל שאר המתכות (למעט מתכות מהקבוצה הראשונה, השנייה, השלישית של תת הקבוצות העיקריות).
כמעט כל הלא מתכות.
לחמצן יש כמעט תמיד מצב חמצון
כללים להצבת מקדמים בשיטת האיזון האלקטרוני. 1. מסדרים את מצבי החמצון.
2. רשום את היסודות ששינו את מצבי החמצון שלהם, תוך ציון מספר האלקטרונים שנתרמו ונקלטו. קבע את חומר החמצון והחומר המצמצם.
3. הגדר מקדמים נוספים, השוו את מספר האלקטרונים הנתונים והמתקבלים.
4. בדקו את המקדמים הללו: הם חייבים להתאים למספר האטומים של יסוד נתון במולקולה. לדוגמה, אם המקדם הנוסף הוא אי זוגי, ומספר האטומים במולקולה הוא זוגי (לדוגמה, Cl 2), אז שני המקדמים הנוספים מוכפלים.
5. המקדמים המאומתים מועברים לתוך המשוואה לאותם אטומים המתרחשים במשוואה פעם אחת עם מצב חמצון נתון.
6. השוואת אטומי מתכת; לא מתכות; מֵימָן.
7. בדוק אם יש חמצן.
