धातुओं और अधातुओं के सभी रासायनिक गुण। धातुओं और अधातुओं में अंतर
रसायनज्ञों ने सभी साधारण पदार्थों को धातुओं और अधातुओं में विभाजित किया। वे संरचना, भौतिक और रासायनिक गुणों में बहुत भिन्न हैं। उनमें से कई को दृष्टि से भेद करना आसान है, उदाहरण के लिए, तांबा एक धातु है, और ब्रोमीन एक गैर-धातु है। हालांकि, तत्वों के वर्गीकरण में गलती न करने के लिए, धातुओं और अधातुओं में निहित स्पष्ट विशेषताओं के ज्ञान पर भरोसा करना बेहतर है।
परिभाषा
बाह्य ऊर्जा स्तर से इलेक्ट्रॉन दान करने वाले तत्व कहलाते हैं धातुओं. धातु, एक नियम के रूप में, ठोस पदार्थ हैं (पारा एक विशेष मामला है, जो सामान्य परिस्थितियों में एक तरल है)।
वे तत्व जो इलेक्ट्रॉनों को उनके बाह्य ऊर्जा स्तर पर स्वीकार करते हैं, हैं गैर धातु. वे एकत्रीकरण के विभिन्न राज्यों में हैं। ऑक्सीजन और नाइट्रोजन गैसें हैं, ब्रोमीन एक तरल है, और ठोस में शामिल हैं, उदाहरण के लिए, आर्सेनिक, कार्बन और बोरॉन।
तुलना
सभी धातुएं धात्विक चमक से संपन्न होती हैं, वे बिजली और गर्मी के उत्कृष्ट संवाहक हैं। उनमें से ज्यादातर प्लास्टिक हैं, भौतिक प्रभाव के साथ, धातु आसानी से आकार बदलते हैं। दूसरी ओर, अधातुएँ ऊष्मा और बिजली की कुचालक होती हैं।
धातुओं और अधातुओं की संरचना मुख्य विशिष्ट विशेषता है। अधातु बाहरी स्तरों पर स्थित अयुग्मित इलेक्ट्रॉनों की एक बड़ी संख्या के स्वामी हैं। धातुओं में एक धात्विक क्रिस्टल जाली होती है। और अधातुओं में आणविक (उदाहरण के लिए, ऑक्सीजन, क्लोरीन और सल्फर) और परमाणु (कार्बन बनाने वाला हीरा) क्रिस्टल जाली होते हैं।
धातुओं में कम विद्युत ऋणात्मकता होती है, और इसलिए रेडॉक्स क्षमता कम होती है। वे इलेक्ट्रॉनों को स्वीकार करते हैं और ऑक्सीकरण करते हैं, कम करने वाले गुणों का प्रदर्शन करते हैं। उच्च इलेक्ट्रोनगेटिविटी और महत्वपूर्ण रेडॉक्स क्षमता के साथ संपन्न गैर-धातुएं ऑक्सीकरण एजेंटों और कम करने वाले एजेंटों के रूप में कार्य कर सकती हैं (यह सबसे शक्तिशाली ऑक्सीकरण एजेंट की उपस्थिति में संभव है)।
धातुओं का एक बहुत ही रोचक गुण है - उभयचरता। उभयधर्मी धातुओं में धातु और अधातु दोनों के गुण होते हैं। उदाहरण के लिए, जस्ता, उच्चतम ऑक्सीकरण अवस्था में होने के कारण, एक अधातु की तरह व्यवहार करता है।
खोज साइट
- भौतिक गुणों में।
- परमाणुओं की संरचना में।
- क्रिस्टल जाली में।
- रासायनिक गुणों में।
- रेडॉक्स गुणों को प्रदर्शित करने की क्षमता।
- धातुओं की उभयचरता में।
गैर धातु प्राकृतिक यौगिक उनके प्रसंस्करण के उत्पादों का उपयोग
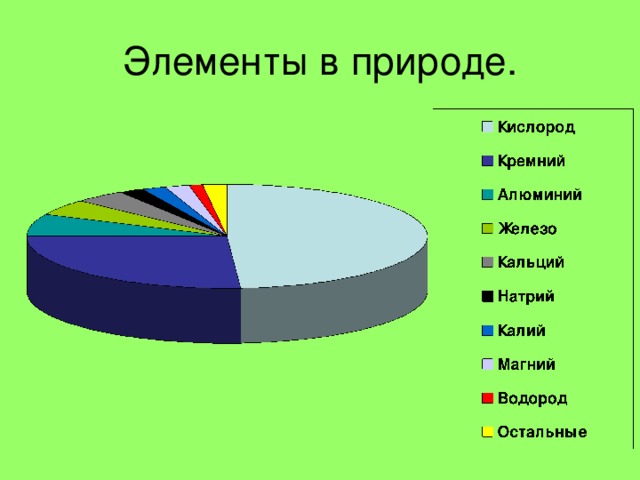

प्रकृति में होना .
मूल तत्व
हवा में नाइट्रोजन और ऑक्सीजन, अक्रिय गैसें
गंधक
ग्रेफाइट सी
हीरा सी

प्रकृति में होना
← उदासीनता आर
सेंधा नमक NaCl →
← फेज़ 2 पाइराइट
क्वार्ट्ज सिओ 2 →

गैर धातु - ये है रासायनिक तत्व, जो गुणों को प्रदर्शित कर सकता है जैसे ऑक्सीकरण एजेंट (इलेक्ट्रॉनों को स्वीकार करें), और अपचायक कारक (इलेक्ट्रॉनों का दान करें)।
समुद्री मील दूर - उच्च OEE वाले तत्व (2 - 4)
अपवाद: एक अधातु तत्त्व - केवल ऑक्सीडेंट
अक्रिय गैसें केवल इलेक्ट्रॉन दान कर सकते हैं।
हीलियम, नियॉन और आर्गन - कनेक्शन न बनाएं।
अधातुओं के यौगिक।
- ऑक्साइड - केवल अम्लीय
इसलिए 3 , इसलिए 2 , सीओ 2 और दूसरे।
- (अलावा ना तथा सीओ - उदासीन)
- हाइड्रॉक्साइड्स - केवल अम्ल
एच 2 इसलिए 4 , एच 2 इसलिए 3 ,एच 2 सीओ 3 और दूसरे
हाइड्रोजन के साथ वाष्पशील यौगिक बनाते हैं एचसीएल, एनएच 3 …
जवाब में स्थिति
मैं लेकिन
द्वितीय लेकिन
तृतीय लेकिन
चतुर्थ लेकिन
वी लेकिन
5 बी
छठी लेकिन
6 सी
सातवीं लेकिन
14 सि
1 एच
7 एन
आठवीं लेकिन
15 पी
8 हे
16 एस
2 वह
9 एफ
33 जैसा
34 से
10 Ne
17 क्लोरीन
35 बीआर
52 ते
18 एआर
36 कृ
53 मैं
54 ज़ी
85 पर
86 आर एन

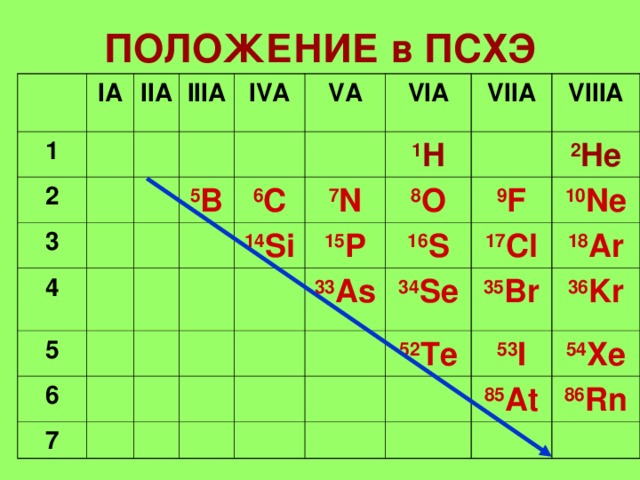
तत्वों - आईए, आईआईआईए, आईवीए

PNICTOGENS -वीए

चेलकोजीन - के जरिए

हलोजन - VIIA

अक्रिय गैसें - आठवीं

परमाणु संरचना NeM
1. तत्व III-VIII समूहों (ए) के मुख्य उपसमूहों में स्थित हैं।
2. अंतिम स्तर पर 3 - 7(8) इलेक्ट्रॉन।
3. परमाणु की त्रिज्या घटती है
4. गैर-धातु गुण
अवधि में - वृद्धि
समूह में - कमी

परमाणु संरचना NeM
- 5. उच्च वैद्युतीयऋणात्मकता।
- 6. वे इलेक्ट्रॉनों को स्वीकार करते हैं और उन्हें दे देते हैं।
- 7. NeM → अम्ल ऑक्साइड → अम्ल
- 8. वाष्पशील हाइड्रोजन यौगिक
(अम्ल, क्षार और उदासीन)

- एकत्रीकरण की स्थिति .
- गैसीय - नाइट्रोजन, ऑक्सीजन, क्लोरीन, अक्रिय गैसें, हाइड्रोजन।
- तरल - ब्रोमीन,
- ठोस - सल्फर, फास्फोरस, कार्बन ...
- पानी में घुलनशीलता।
- अघुलनशील।
- विद्युत धारा से संबंध।
- गैर-प्रवाहकीय: सल्फर, ऑक्सीजन…
- कंडक्टर: ग्रेफाइट
- अर्धचालक: सिलिकॉन

अधातुओं की संरचना .
- आण्विक (एचईएम), जहां
- अक्रिय गैसें He, Ar, Ne…
- एच 2, सीएल 2, एन 2 ...
- पी 4 सफेद
- पी एन लाल
- परमाण्विक संरचना
- (सी) एन-डायमंड, ग्रेफाइट;
- (सी) एन सिलिकॉन;
- (बी) एन बोरोन


अधिकांश अधातुओं में एकत्रीकरण की ठोस अवस्था होती है।
सल्फर एक पीला क्रिस्टलीय पदार्थ है
लाल फास्फोरस
कार्बन (कोयला)

अधातुएं जल में विरल रूप से घुलनशील होती हैं
कोयला
फास्फोरस
सल्फर पानी से गीला नहीं होता है

- 1. धातुओं के साथ अभिक्रिया करें।
- 2. ऑक्सीजन के साथ।
- 3. हाइड्रोजन के साथ।
- 4. एसिड के साथ।
- 5. क्षार के साथ।
- 6. लवण के साथ।
गैर-धातु गुणों वाले तत्व IIIA-VIIA में हैं - आवधिक प्रणाली के समूह:
|
आमतौर पर, हाइड्रोजन एच को गैर-धातुओं में भी माना जाता है, हालांकि यह पूरी तरह से सटीक नहीं है, क्योंकि गैर-धातु और धातु दोनों हाइड्रोजन में निहित हैं। रासायनिक गुण.
सामान्य इलेक्ट्रॉनिक सूत्रअधातु परमाणु एनएस 2 एनपी 1−5 , यह एक बड़े . से मेल खाती है ऑक्सीकरण राज्यों की विविधतायौगिकों में गैर-धातु। गैर-धातुओं की एक विशेषता विशेषता उनके परमाणुओं के बाहरी ऊर्जा स्तर पर इलेक्ट्रॉनों की एक बड़ी (धातुओं की तुलना में) संख्या है। यह अतिरिक्त इलेक्ट्रॉनों को जोड़ने और उच्च प्रदर्शित करने की उनकी महान क्षमता को निर्धारित करता है ऑक्सीडेटिव गतिविधि. इसलिए मान वैद्युतीयऋणात्मकताउनके पास बड़े हैं। इसलिए रासायनिक गुणों और अधातुओं को प्राप्त करने के तरीकों में विविधता।
अन्य मुख्य विशेषताएंअधातु - बनने की इच्छा सहसंयोजी आबंधअन्य अधातुओं और उभयधर्मी तत्वों के परमाणुओं के साथ। इसलिए, सरल पदार्थों और गैर-धातु यौगिकों दोनों में एक सहसंयोजक संरचना होती है।
आज़ादी से मिला गैसीयपदार्थ - एफ 2, सीएल 2, ओ 2, एन 2 और एच 2, ठोस- I 2 , At, S, Te, P, As, C, Si और B, एक को कमरे के तापमान पर जाना जाता है तरलअधातु - ब्रोमीन Br 2.
अक्सर गैर-धातुओं के लिए मनाया जाता है अपररूपता, उदाहरण के लिए, ऑक्सीजन (O 2 और O 3) और कार्बन (ग्रेफाइट, हीरा, कार्बाइन, फुलरीन)।
प्रकृति में पाया जाता है देशी अधातु- एन 2 और ओ 2 (हवा में), सल्फर (पृथ्वी की पपड़ी में), लेकिन अक्सर प्रकृति में गैर-धातुएं रासायनिक रूप से बाध्य रूप में होती हैं। सबसे पहले, यह पानीऔर उसमें घुल गया नमक, फिर - खनिज पदार्थतथा चट्टानों(जैसे विभिन्न सिलिकेट , एल्युमिनोसिलिकेट्स , फॉस्फेट , बोराटेस , सल्फेट्स तथा कार्बोनेट्स ).
पृथ्वी की पपड़ी में व्यापकता के संदर्भ में, गैर-धातुएं विभिन्न स्थानों पर कब्जा कर लेती हैं: तीन सबसे सामान्य तत्वों (ओ, सी, एच) से लेकर बहुत दुर्लभ (अस, से, आई, ते)।
हैलोजन
हलोजन उपसमूह में फ्लोरीन, क्लोरीन, ब्रोमीन, आयोडीन और एस्टैटिन शामिल हैं। पहले चार तत्व प्रकृति में विभिन्न यौगिकों के रूप में पाए जाते हैं। एस्टैटिन केवल कृत्रिम रूप से प्राप्त किया जाता है, यह रेडियोधर्मी है। ये डी। आई। मेंडेलीव की आवधिक प्रणाली के VII समूह के पी-तत्व हैं। बाहरी ऊर्जा स्तर पर, उनके परमाणुओं में 7 इलेक्ट्रॉन होते हैं एनएस2एनपी5(तालिका 1 देखें)।
यह उनके गुणों की समानता की व्याख्या करता है। वे आसानी से एक समय में एक इलेक्ट्रॉन जोड़ते हैं, -1 की ऑक्सीकरण अवस्था दिखाते हैं। हैलोजन में हाइड्रोजन और धातुओं के साथ यौगिकों में यह ऑक्सीकरण अवस्था होती है। हालांकि, फ्लोरीन के अलावा हलोजन परमाणु भी सकारात्मक ऑक्सीकरण राज्यों को प्रदर्शित कर सकते हैं: +1, +3, +5, +7। ऑक्सीकरण राज्यों के संभावित मूल्यों को परमाणुओं की इलेक्ट्रॉनिक संरचना द्वारा समझाया गया है, जिसे फ्लोरीन परमाणु पर योजना द्वारा दर्शाया जा सकता है:
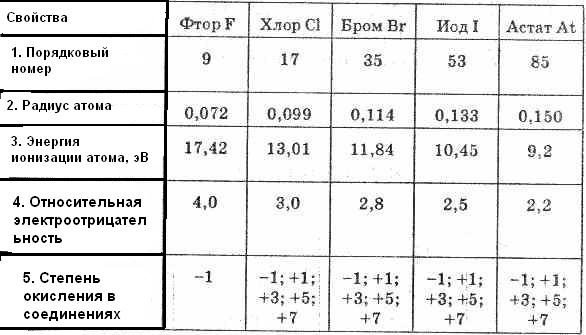
तालिका 1. हलोजन उपसमूह के तत्वों के गुण
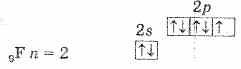
सबसे अधिक विद्युत ऋणात्मक तत्व होने के कारण, फ्लोरीन प्रति 2p स्तर पर केवल एक इलेक्ट्रॉन स्वीकार कर सकता है। इसमें एक अयुग्मित इलेक्ट्रॉन होता है, इसलिए फ्लोरीन केवल मोनोवैलेंट होता है, और इसकी ऑक्सीकरण अवस्था हमेशा -1 होती है।
क्लोरीन परमाणु की इलेक्ट्रॉनिक संरचना योजना द्वारा व्यक्त की जाती है:
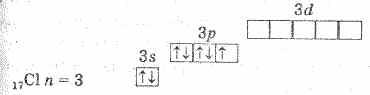
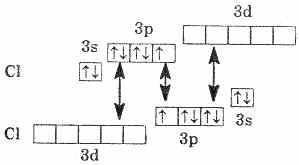
क्लोरीन परमाणु में 3p सबलेवल में एक अयुग्मित इलेक्ट्रॉन होता है, और सामान्य (अप्रत्याशित) अवस्था में, क्लोरीन मोनोवैलेंट होता है। लेकिन चूंकि क्लोरीन तीसरी अवधि में है, इसलिए इसमें 3डी सबलेवल के पांच और ऑर्बिटल्स हैं, जो 10 इलेक्ट्रॉनों को समायोजित कर सकते हैं।
परमाणु की उत्तेजित अवस्था में, क्लोरीन इलेक्ट्रॉन 3p- और 3s-उप-स्तर से 3d-उप-स्तर (आरेख में तीरों द्वारा दिखाए गए) तक जाते हैं। एक ही कक्षक में स्थित इलेक्ट्रॉनों के पृथक्करण (युग्मन) से संयोजकता दो इकाई बढ़ जाती है। जाहिर है, क्लोरीन और इसके एनालॉग्स (फ्लोरीन को छोड़कर) केवल 1,3,5,7 की एक विषम चर वैलेंस और संबंधित सकारात्मक ऑक्सीकरण अवस्था प्रदर्शित कर सकते हैं। फ्लुओरीन का कोई मुक्त कक्षक नहीं होता है, जिसका अर्थ है कि रसायनिक प्रतिक्रियापरमाणु में युग्मित इलेक्ट्रॉनों का पृथक्करण नहीं होता है। इसलिए, हैलोजन के गुणों पर विचार करते समय, हमेशा फ्लोरीन की विशेषताओं को ध्यान में रखना चाहिए।
प्रत्येक अवधि के भीतर, हैलोजन उच्चतम इलेक्ट्रॉन आत्मीयता वाले सबसे अधिक विद्युतीय तत्व होते हैं।
हलोजन उपसमूह के भीतर, फ्लोरीन से आयोडीन में संक्रमण के साथ परमाणु त्रिज्या में वृद्धि होती है।
उप-समूह के तत्व अधातु हैं; जैसे-जैसे परमाणु आवेश F से At तक बढ़ता है, गैर-धातु विशेषताएँ कमजोर होती हैं, जैसा कि आयनीकरण क्षमता और इलेक्ट्रॉन आत्मीयता में कमी के कारण होता है।
रेडॉक्स गुण और हैलोजन के रासायनिक व्यवहार में अंतर को F से I पर जाने पर परमाणु आवेश में परिवर्तन के आधार पर इन गुणों की तुलना करके आसानी से समझा जा सकता है। श्रृंखला F, Cl, Br, I में, सबसे बड़ा परमाणु त्रिज्या (और , इसलिए, सबसे कम इलेक्ट्रॉन आत्मीयता ) में I है, इसलिए यह Br, Cl, F की तुलना में कम स्पष्ट ऑक्सीकरण गुणों की विशेषता है। इसलिए, हलोजन उपसमूह में तटस्थ परमाणुओं के ऑक्सीकरण गुण F से I तक कम हो जाते हैं, और कम करने वाले गुण बढ़ जाते हैं :

अणुओं में गैल-गैल बंधन सरल पदार्थसहसंयोजक गैर-ध्रुवीय। अणु में F 2 से I 2 तक बंधन की लंबाई स्वाभाविक रूप से बढ़ जाती है। बाध्यकारी ऊर्जा निम्नानुसार बदलती है।
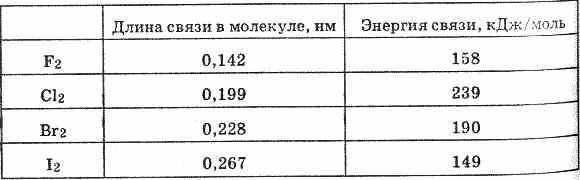
F2 अणु में बाध्यकारी ऊर्जा Cl2 अणु की तुलना में कम मजबूत होती है। यह Cl2 अणु में एक मूल बंधन के गठन द्वारा समझाया गया है और, तदनुसार, Br2 और I2: जब एक सामान्य ऊर्जा बादल न केवल p-इलेक्ट्रॉनों की जोड़ी के कारण बनता है, बल्कि पहले से मौजूद युग्मित p- के कारण भी बनता है। एक परमाणु के इलेक्ट्रॉन तथा दूसरे परमाणु के रिक्त d-कक्षक।
आर - 1 से 3 ई तक बाह्य ऊर्जा स्तर पर परमाणु की संरचना: - आर - 1 से 3 ई तक बाह्य ऊर्जा स्तर पर परमाणु की संरचना: - 2धातुओं और गैर-धातुओं के सामान्य लक्षण परमाणुओं को धातुओं में वर्गीकृत किया जाता है गैर-धातुओं में परमाणु की संरचना होती है: -\u003e आर - बाहरी ऊर्जा स्तर पर 1 से 3 ई तक परमाणु की संरचना: - आर - 1 से 1 तक बाहरी ऊर्जा स्तर पर 3 ई परमाणु की संरचना: - आर - बाहरी ऊर्जा स्तर पर 1 से 3 तक परमाणु की संरचना: - आर - बाहरी ऊर्जा स्तर पर 1 से 3 ई तक परमाणु की संरचना: - आर - बाहरी ऊर्जा स्तर पर 1 से 3e तक परमाणु की संरचना: - शीर्षक = "(!LANG: धातुओं और गैर-धातु परमाणुओं की सामान्य विशेषताओं को धातुओं में वर्गीकृत किया जाता है। गैर-धातुओं में परमाणु की संरचना होती है: -\u003e आर - बाह्य ऊर्जा स्तर पर 1 से 3 ई तक।परमाणु की संरचना:-
सरल पदार्थ बनाते हैं रासायनिक यौगिक: क्षारकीय ऑक्साइड उभयधर्मी आक्साइड लवण क्षार रासायनिक यौगिक: अम्लीय आक्साइड हाइड्रोजन यौगिक अम्ल लवण साधारण पदार्थों में Phys होता है। गुण: विद्युत और तापीय चालकता मुझे चमक प्लास्टिसिटी ठोस चांदी-सफेद रंग केम। गुण, के साथ प्रतिक्रिया करें: अम्ल नहीं जल लवण Phys. गुण: गैर-विद्युत और तापीय चालकता नाजुक गैसें, तरल पदार्थ, ठोस विभिन्न रंग रसायन। गुण, इसके साथ प्रतिक्रिया करें: Me He अम्ल धातु बंधन धातु क्रिस्टल जाली सहसंयोजक बंधनपरमाणु और आणविक क्रिस्टल जाली निर्धारित होती है
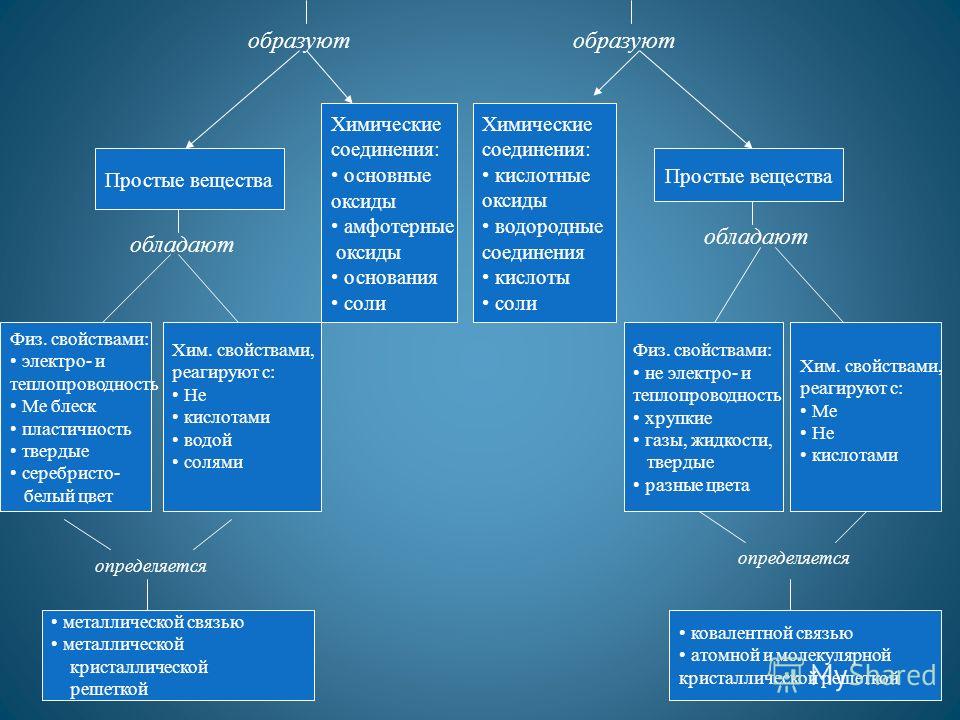
![]()


संरचना: परमाणु (Si, B), आणविक (Н 2, N 2, Br 2) कुल अवस्था: - गैसें - H 2, O 2, O 3, N 2, F 2, Cl 2; - तरल - बीआर 2; - ठोस - सल्फर, फास्फोरस, सिलिकॉन, कार्बन, आदि के संशोधन। अधिकांश गैर-धातु विद्युत प्रवाहकीय नहीं हैं, कम तापीय चालकता है, और ठोस गैर-प्लास्टिक हैं।
![]()
अपररूपता

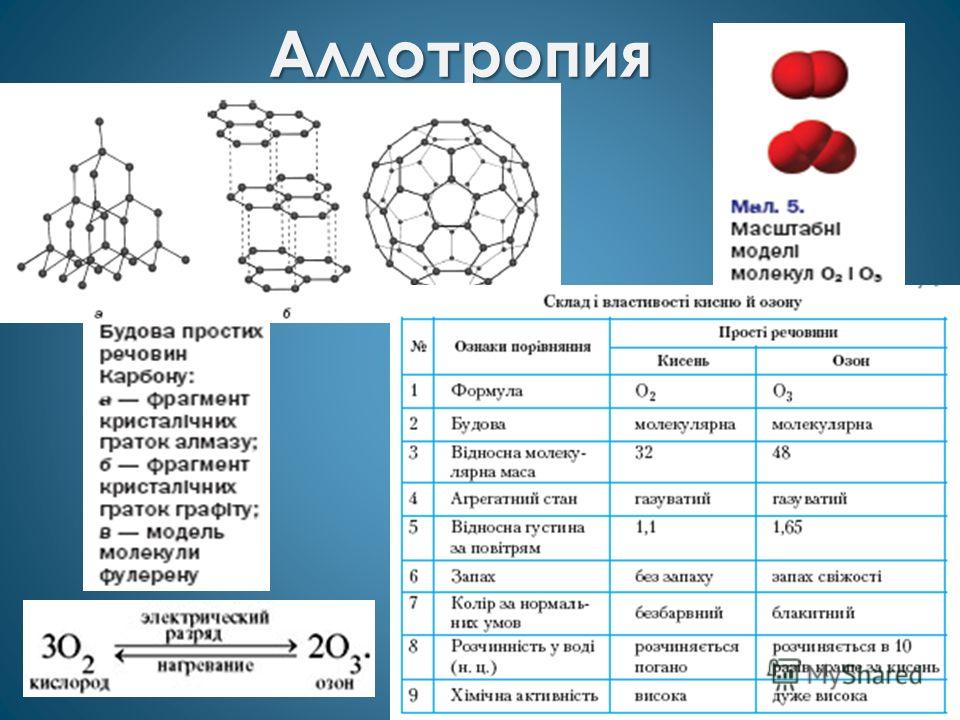
मिलान: पदार्थों के जोड़े में से, "अतिरिक्त" चुनें: ए) सफेद और लाल फास्फोरस बी) ऑक्सीजन और ओजोन सी) सिलिका और क्वार्ट्ज डी) हीरा और ग्रेफाइट गैर-धातु गुण परमाणुओं द्वारा गठित एक साधारण पदार्थ में सबसे अधिक स्पष्ट होते हैं: ए) फ्लोरीन बी) ऑक्सीजन सी) सिलिकॉन डी) नाइट्रोजन सरल पदार्थ 1. तांबा2। सल्फर3. हीरा 4. सफेद फास्फोरस क्रिस्टल जाली ए) आणविक बी) परमाणु सी) धातु

गैर-धातुओं के हाइड्रोजन यौगिक बी 2 एच 6 डिबोरेन सीएच 4 मीथेन एनएच 3 अमोनिया एच 2 ओ पानी एचएफ हाइड्रोजन फ्लोराइड सीएच 4 सिलेन पीएच 3 फॉस्फीन एच 2 एस हाइड्रोजन सल्फाइड एचसीएल हाइड्रोजन क्लोराइड जीएच 4 जर्मन एएसएच 3 आर्सिन एच 2 से हाइड्रोजन सेलेनाइड एचबीआर हाइड्रोजन ब्रोमाइड एच 2 ते हाइड्रोजन टेलुराइड HI हाइड्रोजन आयोडाइड

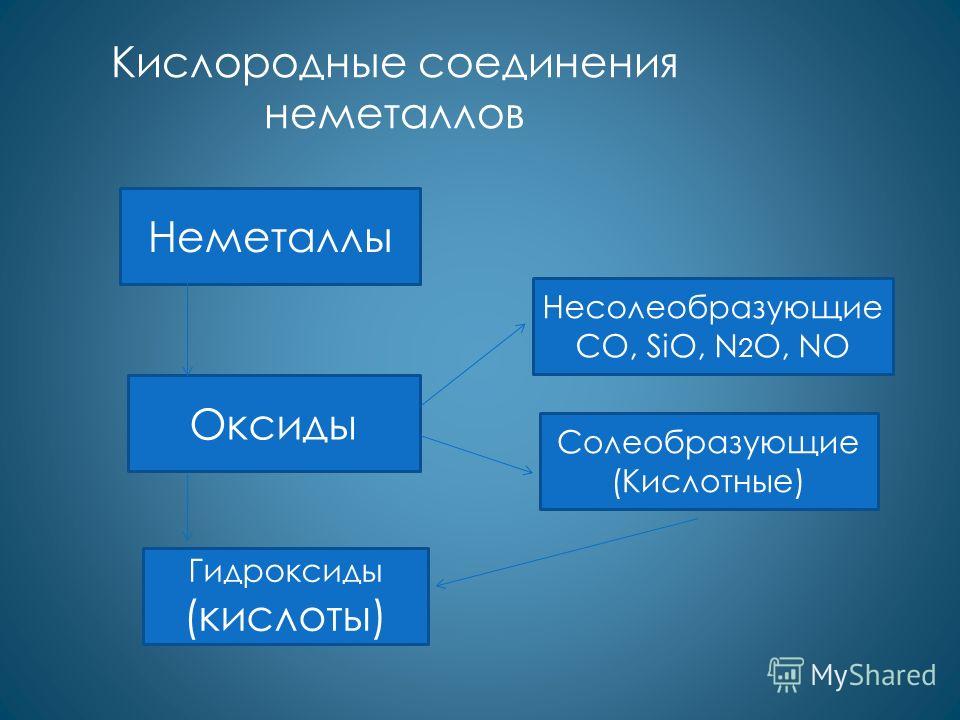
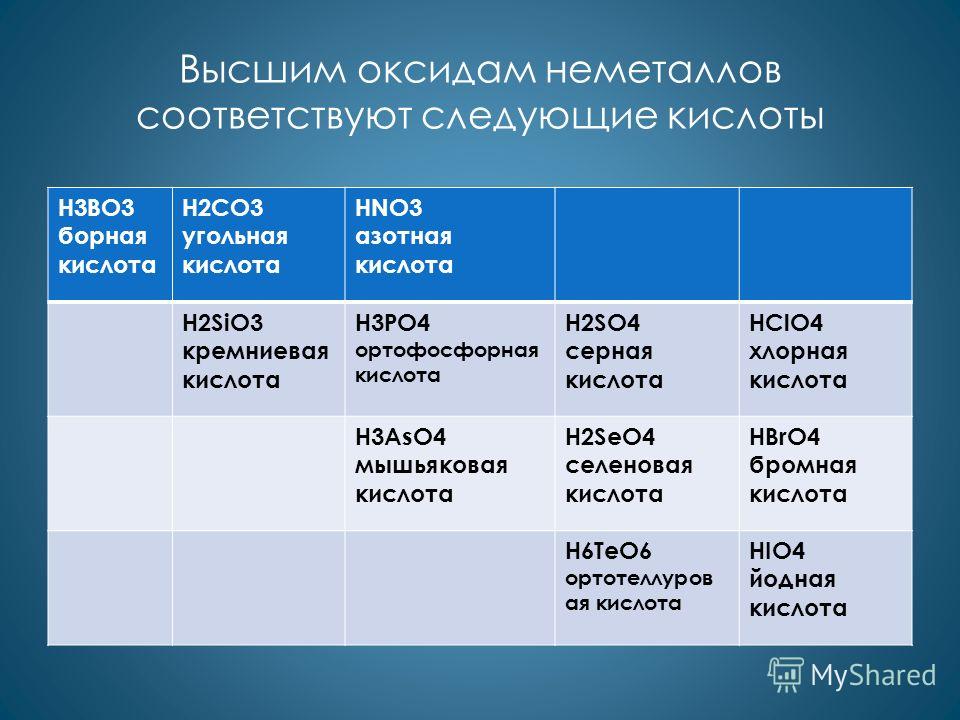
निम्नलिखित एसिड गैर-धातुओं के उच्च ऑक्साइड H3BO3 बोरिक एसिड H2CO3 कार्बोनिक एसिड HNO3 नाइट्रिक एसिड H2SiO3 सिलिकिक एसिड H3PO4 ऑर्थोफॉस्फोरिक एसिड H2SO4 सल्फ्यूरिक एसिड HClO4 परक्लोरिक एसिड H3AsO4 आर्सेनिक एसिड H2SeO4 सेलेनिक एसिड H6O4 सेलेनिक एसिड HBrO4 सेलेनिक एसिड H6TeO4 ब्रोमिक एसिड के उच्च ऑक्साइड के अनुरूप हैं।

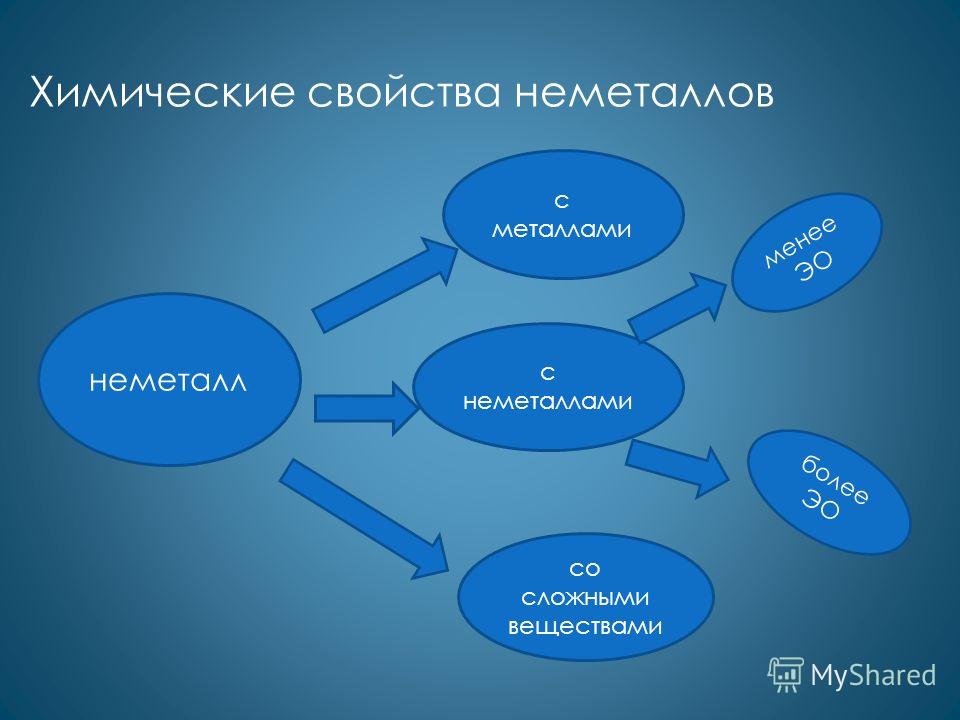
ऑक्सीकरण गुण अधिकांश गैर-धातुओं की विशेषता है। ऑक्सीकरण एजेंटों के रूप में, वे धातुओं के साथ प्रतिक्रिया करते हैं: Ca + Cl 2 = CaCl 2 4Li + O 2 = 2Li 2 O 2Na + S = Na 2 S कम विद्युतीय गैर-धातुओं के साथ: H 2 + S = H 2 S P 4 + 5O 2 = 2P 2 O 5 2P + 5Cl 2 = 2PCl 5 co जटिल पदार्थ: 2FeCl 2 + Cl 2 = 2FeCl 3 CH 4 + Br 2 = CH 3 Br + HBr

अपचायक गुण अधातुओं की कम विशेषता है। एजेंटों को कम करने के रूप में, वे अधिक विद्युतीय गैर-धातुओं के साथ प्रतिक्रिया करते हैं: Si + 2F 2 = SiF 4 C + O 2 = CO 2 C + 2S = CS 2 जटिल पदार्थों के साथ: H 2 + HCHO = CH 3 OH 6P + 5KClO 3 = 5KCl + 3P 2 O 5


पदार्थ सामान्य गुण भेद गुण साधारण पदार्थ - अधातु 1. धातुओं के साथ 2. अधातुओं के साथ 1. हलोजन एक दूसरे को नमक के घोल से विस्थापित करते हैं। 2. ऑक्सीजन जटिल पदार्थों के साथ प्रतिक्रिया करता है 3. कार्बन धातु ऑक्साइड के साथ प्रतिक्रिया करता है 4. कार्बन कार्बन डाइऑक्साइड के साथ प्रतिक्रिया करता है 5. सिलिकॉन क्षार समाधान के साथ प्रतिक्रिया करता है गैर-धातुओं और कुछ यौगिकों के रासायनिक गुण

पदार्थ सामान्य गुण विशिष्ट गुण एसिड ऑक्साइड 1. पानी के साथ (सिलिकॉन ऑक्साइड को छोड़कर) 2. मूल ऑक्साइड के साथ 3. क्षार के साथ 1. कार्बन डाइऑक्साइड और सिलिकॉन ऑक्साइड मैग्नीशियम के साथ प्रतिक्रिया करते हैं 2. सिलिकॉन ऑक्साइड कार्बन के साथ प्रतिक्रिया करता है 3. सिलिकॉन ऑक्साइड लवण के साथ प्रतिक्रिया करता है, अधिक वाष्पशील ऑक्साइडों को विस्थापित करना अधातुओं और कुछ यौगिकों के रासायनिक गुण

पदार्थ सामान्य गुण विशिष्ट गुण एसिड 1. संकेतकों का रंग बदलें 2. धातुओं के साथ प्रतिक्रिया करें 3. मूल और एम्फोटेरिक ऑक्साइड के साथ प्रतिक्रिया करें 4. क्षार और एम्फोटेरिक हाइड्रॉक्साइड के साथ 5. लवण के साथ 1. हाइड्रोफ्लोरिक एसिड सिलिकॉन ऑक्साइड के साथ प्रतिक्रिया करता है 2. नाइट्रिक और केंद्रित सल्फ्यूरिक एसिड एक विशेष तरीके से धातुओं के साथ प्रतिक्रिया करता है 3. गर्म होने पर, नाइट्रिक, कार्बोनिक, सिलिकिक एसिड अधातुओं और कुछ यौगिकों के रासायनिक गुणों को विघटित करते हैं।

पदार्थ सामान्य गुण विशिष्ट गुण लवण 1. नमक के घोल के साथ 2. अम्ल के साथ 3. क्षार के साथ 1. गर्म होने पर, नाइट्रेट, अमोनियम लवण, कार्बोनेट विघटित होते हैं (क्षार धातु कार्बोनेट को छोड़कर) गैर-धातुओं और कुछ यौगिकों के रासायनिक गुण

रसायन विज्ञान का पाठ, ग्रेड 9. (ओ.एस. गैब्रिएलियन)
गैर-धातु। सामान्य विशेषताएँ। एलोट्रॉपी।
लक्ष्य: धातुओं के साथ विरोध का उपयोग करते हुए, पीएसएम में गैर-धातुओं की स्थिति और परमाणुओं की संरचनात्मक विशेषताओं पर विचार करें, वैद्युतीयऋणात्मकता की श्रृंखला को याद करें। अपररूपता की अवधारणा और अधातुओं की क्रिस्टलीय संरचना को दोहराएं, और इसलिए उन पर विचार करें भौतिक गुण. हवा की संरचना पर विचार करें। चेतन और निर्जीव प्रकृति में अधातुओं की भूमिका।
उपकरण : मल्टीमीडिया इंस्टॉलेशन, इलेक्ट्रॉनिक लाइब्रेरी "एनलाइटनमेंट", घरेलू कीटनाशकों, डिओडोरेंट्स, वार्निश, हीरे और ग्रेफाइट के क्रिस्टल जाली, एल्यूमीनियम और तांबे के तार के साथ एयरोसोल पैकेज।
पाठ प्रकार : संयुक्त।
शिक्षण योजना
Ӏ .प्रेरणा-सूचक चरण
1) पिछले पाठ में प्राप्त ज्ञान को अद्यतन करना
2) पाठ लक्ष्य निर्धारित करना
ӀӀ .संचालन और कार्यकारी चरण
1) तालिका में अधातुओं की स्थिति D.I. मेंडलीव
2) सकल राज्य
3) एलोट्रॉपी
4) हवा की संरचना
5) अधातुओं के अनुप्रयोग
ӀӀӀ. मूल्यांकन-चिंतनशील चरण
नियंत्रण और आत्म-नियंत्रण: परीक्षणों के साथ काम करें
निष्कर्ष
एक। सभी रासायनिक तत्वों को उनके परमाणुओं की संरचना और गुणों के आधार पर धातुओं और अधातुओं में विभाजित किया जाता है। इन तत्वों से बनने वाले साधारण पदार्थों को भी भौतिक और रासायनिक गुणों के आधार पर धातुओं और अधातुओं में विभाजित किया जाता है। आप धातुओं से पहले से ही परिचित हैं। और आज, धातुओं के साथ विरोध का प्रयोग करते हुए, हम अधातुओं के गुणों पर विचार करेंगे।
. आवर्त सारणी और रसायन शास्त्र में एक डिस्क का उपयोग करके तालिका भरें। (प्रत्येक में डेस्क पर एक खाली तालिका का एक नमूना है)
तुलनात्मक विशेषताएंधातु और अधातु मछली पकड़ने
विशेषता
धातुओं
nonmetals
परमाणु की संरचना
1 से 3 इलेक्ट्रॉन
4 से अधिक इलेक्ट्रॉन
RADIUS
बड़ा
छोटा
रासायनिक गुण
अपचायक कारक
आक्सीकारक। फ्लोरीन सबसे मजबूत ऑक्सीकरण एजेंट है
एकत्रीकरण की स्थिति
ठोस (पारा को छोड़कर)
ठोस, तरल, गैसें
रंग
सिल्वर ग्रे (सोना, कॉपर को छोड़कर)
रंगों का स्पेक्ट्रम
चमक
धातु
नहीं
इलेक्ट्रिकल कंडक्टीविटी
आचरण वर्तमान
प्रवाहकीय नहीं (ग्रेफाइट को छोड़कर)
तालिका देखें और अपना निष्कर्ष निकालें।
निष्कर्ष: अधातु वे रासायनिक तत्व हैं जो साधारण पदार्थ बनाते हैं जिनमें धातुओं के गुण नहीं होते हैं।
गलनांक 3800 (ग्रेफाइट) से - 210 (नाइट्रोजन) तक। इस तरह की एक विस्तृत श्रृंखला को दो प्रकार के क्रिस्टल जाली द्वारा समझाया गया है: आणविक (O .) 2 , ओ 3 ) और परमाणु (ग्रेफाइट, हीरा)।
यदि धातु-साधारण पदार्थ धात्विक बंध से बनते हैं, तो अधातु-सरल पदार्थ सहसंयोजक अध्रुवीय रासायनिक बंध द्वारा अभिलक्षित होते हैं।
क्रिस्टल जाली की विभिन्न संरचना एलोट्रॉपी की घटना की व्याख्या करता है।
एलोट्रॉपी को परिभाषित करें।
लाल फास्फोरस -परमाणु जाली (माचिस और उर्वरकों के उत्पादन में प्रयुक्त)
सफेद फास्फोरस - आणविक (पी 4 ) उर्वरकों के उत्पादन में, सैन्य मामलों में: धूम्रपान बम, कीटनाशक।
ग्रेफाइट-परमाणु (जाल दिखाएं)। नोगिंस्क ग्रेफाइट खदान
हीरा - परमाणु (याकूतिया)।
एलोट्रॉपी का दूसरा कारण - परमाणुओं की अलग-अलग संख्या (ऑक्सीजन और ओजोन)। ये गैसें मजबूत ऑक्सीकरण एजेंट हैं। पराबैंगनी सौर विकिरण कुछ ऑक्सीजन अणुओं को अलग-अलग परमाणुओं में विभाजित करता है, जो ऑक्सीजन के साथ बातचीत करते हैं और ओजोन बनाते हैं। 25 किमी की ऊंचाई पर ओजोन परत है। यह एक ढाल के रूप में कार्य करता है, पृथ्वी को कठोर यूवी विकिरण से बचाता है। वायुयान से निकलने वाली गैसें, प्रशीतन इकाइयों (फ्रीऑन) में प्रयुक्त पदार्थों के कुछ एरोसोल ओजोन परत को नष्ट कर देते हैं। पौधे ओजोन परत में एक छिद्र की उपस्थिति से पीड़ित होते हैं, और त्वचा कैंसर का खतरा बढ़ जाता है।
ओज़ोन का निर्माण आंधी के बाद होता है चीड़ के जंगल, समुद्र तट पर।
पाठ्यपुस्तक को p.90 पर खोलें। आइए साधारण पदार्थों ऑक्सीजन और ओजोन की तुलना करें
ऑक्सीजन
ओजोन
बेरंग
हल्का नीला रंग
बिना गंध
तेज गंध के साथ
पानी में थोड़ा घुलनशील
पानी में घुलनशील
जहरीला नहीं
उच्च सांद्रता में जहरीला
वायु सामग्री 21%
2×10 -10
दहन, श्वास का समर्थन करता है
इसका उपयोग कीटाणुशोधन के लिए, कपड़ों को ब्लीच करने के लिए किया जाता है
बहुत बढ़िया!
ओजोन वायु के परिवर्तनशील घटकों में से एक है। हवा क्या है?
डिस्क: वायु रचना। एक नोटबुक में रचना लिखें। वायु का मोलर द्रव्यमान -29 है।
गैसों का उपयोग जो हवा का हिस्सा हैं (स्कूबा गोताखोरों में, ऑक्सीजन और हीलियम का मिश्रण, क्योंकि दबाव में नाइट्रोजन खतरनाक है), हीलियम का उपयोग लेजर के निर्माण में किया जाता है, जो एक तरंग दैर्ध्य के साथ एक स्थिर प्रकाश किरण देता है।
निष्कर्ष: आपने पाठ में अधातुओं के बारे में क्या सीखा?
5-6 मिनट परीक्षण के साथ काम करें, पत्रक एकत्र करें।
गृहकार्य: 15, पी.93 "5" नंबर 2,3ए), 4
"4" - नंबर 2,3 बी)
"3" - नंबर 6 (ओजोन छिद्रों को कैसे चेतावनी दें)
परीक्षण।
1. अधातुएँ आवर्त प्रणाली में स्थित होती हैं:
ए) अवधि की शुरुआत में
बी) अवधि के अंत में
बी) सभी समूहों में
डी) बड़ी अवधि में
2. गैर-धातु परमाणु इलेक्ट्रॉनिक सूत्रों के अनुरूप होते हैं
लेकिन)3एस 2 3पी 1 तथा2एस 2 2पी 1 बी)2एस 2 2पी 1 तथा3एस 2 3पी 1
पर) 2एस 2 2पी 1 तथा2एस 2 2पी 2 जी) 3एस 2 3पी 1 तथा4एस 2
3. प्रस्तावित अधातुओं में गैस है:
ए) सी बी) सी सी) सीआर 2 करना 3
4. एलोट्रोपिक संशोधनों के जोड़े चुनें?
लेकिन)एसऔर आर बी) ओ 2 और उस बारे में 3 बी) सी औरएसडी) वी और आर
