रासायनिक तत्वों की उपस्थिति का इतिहास। तत्वों की खोज का इतिहास
तत्वों की खोज का इतिहास
किरोव, 2008
2.चांदी
5. कोबाल्ट
6.सिलिकॉन
लैटिन ऑरम से। सोना प्राचीन काल से मानव जाति के लिए जाना जाता है। शायद यह पहली धातु थी जिससे मनुष्य मिला था। प्राचीन मिस्र (4100-3900 ईसा पूर्व), भारत और भारत-चीन (2000-1500 ईसा पूर्व) में सोने के खनन और उससे उत्पादों के निर्माण के प्रमाण हैं, जहां से पैसा, महंगे गहने, कला के काम किए जाते थे। और कला। पृथ्वी की पपड़ी में 4.3 10-7%, समुद्रों और महासागरों के पानी में 5 10-6% मिलीग्राम / लीटर से कम होता है। बिखरे हुए तत्वों को संदर्भित करता है। बड़ी डली अत्यंत दुर्लभ हैं और, एक नियम के रूप में, नाममात्र के नाम हैं। हमारे देश में पाए जाने वाले सबसे बड़े सोने की डली का वजन 36 किलो था। यह 1842 में दक्षिणी Urals (Miass माइंस) में पाया गया था। इस सोने की डली को डायमंड फंड में रखा जाता है। रासायनिक यौगिकसोना प्रकृति में दुर्लभ है, मुख्य रूप से टेलुराइड्स, क्रैनेराइट और अन्य। रासायनिक विश्लेषण के आधुनिक तरीकों से पौधों और जानवरों के जीवों में, वाइन और कॉन्यैक में, खनिज पानी में और समुद्र के पानी में एयू की ट्रेस मात्रा की उपस्थिति का पता लगाना संभव हो जाता है। इसके औद्योगिक उत्पादन में सोने के स्रोत गोल्ड प्लेसर और प्राथमिक जमा के अयस्क और रेत हैं, जिनमें से सोने की सामग्री स्रोत सामग्री के 5-15 ग्राम प्रति टन है, साथ ही मध्यवर्ती उत्पाद (0.5-3 ग्राम / टी) सीसा है। -जस्ता, तांबा, यूरेनियम और कुछ अन्य उद्योग। प्लेसर से सोना निकालने की प्रक्रिया सोने और रेत के घनत्व में अंतर पर आधारित है। पानी के शक्तिशाली जेट की मदद से, कुचली हुई सोने की चट्टान को पानी में निलंबित अवस्था में स्थानांतरित कर दिया जाता है। परिणामी लुगदी एक झुकाव वाले विमान के साथ ड्रेज में बहती है। इस मामले में, सोने के भारी कण जम जाते हैं, और रेत के दाने पानी से बह जाते हैं। सोने का गलनांक 1064.4°C, क्वथनांक 2880°C, घनत्व 19.32 kg/dm3 होता है। इसमें असाधारण प्लास्टिसिटी, तापीय चालकता और विद्युत चालकता है। 1 मिमी के व्यास के साथ सोने की एक गेंद को 50 मीटर 2 के क्षेत्र के साथ, नीले-हरे रंग में पारभासी, सबसे पतली शीट में चपटा किया जा सकता है। सोने की सबसे पतली पत्तियों की मोटाई 0.1 माइक्रोन होती है। 1 ग्राम सोने से 2.4 किमी लंबा तार खींचा जा सकता है। 1500 ई.पू. इ। चीन, भारत, मिस्र आदि में सोने का इस्तेमाल पैसे के रूप में किया जाता था। अब सोने और उसके मिश्र धातुओं का उपयोग गहने, सिक्के, पदक, कृत्रिम अंग, रासायनिक उपकरण के कुछ हिस्सों, विद्युत संपर्कों और तारों, माइक्रोइलेक्ट्रॉनिक उत्पादों, रसायन में पाइपों पर क्लैडिंग के लिए किया जाता है। उद्योग, सोल्डर, उत्प्रेरक, घड़ियां, कांच की पेंटिंग, फाउंटेन पेन के लिए निब, धातु की सतहों को कोटिंग के उत्पादन में। आमतौर पर सोने का इस्तेमाल चांदी या पैलेडियम (सफेद सोना) के साथ मिश्र धातु में किया जाता है। मिश्र धातु में सोने की सामग्री राज्य हॉलमार्क द्वारा निर्दिष्ट की जाती है। सोना 583 वजन के हिसाब से 58.3% सोने के साथ एक मिश्र धातु है। कुछ सोने के यौगिक विषाक्त होते हैं, गुर्दे, यकृत, प्लीहा और हाइपोथैलेमस में जमा होते हैं, जिससे कार्बनिक रोग और जिल्द की सूजन, स्टामाटाइटिस, थ्रोम्बोसाइटोपेनिया हो सकता है।
2.सिल्वर
चांदी को प्राचीन काल से जाना जाता है, पहले से ही 4 वीं सहस्राब्दी ईसा पूर्व में, इससे गहने और सिक्के बनाए गए थे। चाँदी को चाँद से जुड़ी धातु माना जाता था। पृथ्वी की पपड़ी में सामग्री वजन के हिसाब से 7 10-6% है। देशी रूप में मिलता है। 60 से अधिक चांदी युक्त खनिजों को जाना जाता है। चांदी के भंडार को उचित चांदी के अयस्कों (50% से ऊपर चांदी की सामग्री) और अलौह और भारी धातुओं के जटिल पॉलीमेटेलिक अयस्कों (चांदी की मात्रा 10-15% तक) में विभाजित किया जाता है। जटिल जमा चांदी के उत्पादन का 80% प्रदान करते हैं। ऐसे अयस्कों का मुख्य भंडार कनाडा, ऑस्ट्रेलिया, पेरू, बोलीविया और जापान में केंद्रित है। प्राचीन काल में चांदी को पारे से उपचारित कर अयस्कों से निकाला जाता था। वर्तमान में साइनाइड लीचिंग का उपयोग किया जा रहा है। बहुत उच्च शुद्धता (99.999%) की चांदी प्राप्त करने के लिए, इसे नाइट्रिक एसिड में विद्युत रासायनिक शोधन के अधीन किया जाता है या केंद्रित सल्फ्यूरिक एसिड में भंग कर दिया जाता है। इस मामले में, चांदी सल्फेट Ag2SO4 के रूप में घोल में चली जाती है। ताँबा या लोहा मिलाने से धात्विक चाँदी का अवक्षेपण होता है। चाँदी-सफ़ेद चमकदार धातु, एक घन मुख-केंद्रित जाली के साथ। घनत्व 10.491 g/cm3, गलनांक 961.93°C, क्वथनांक 2167°C। चांदी एक नरम और नमनीय धातु है, जिसमें 20 डिग्री सेल्सियस पर 419 W/m-1 K-1 की तापीय चालकता और उच्चतम विद्युत चालकता है। चांदी में मौजूद अशुद्धियाँ, थोड़ी मात्रा में भी, इसके यांत्रिक गुणों को ख़राब कर देती हैं। चांदी अपने यौगिकों से अधिक सक्रिय धातुओं द्वारा आसानी से विस्थापित हो जाती है। कमरे के तापमान पर, यह वायुमंडलीय ऑक्सीजन द्वारा ऑक्सीकृत नहीं होता है; 170 डिग्री सेल्सियस पर, इसकी सतह को एजी 2 ओ फिल्म के साथ कवर किया जाता है। नमी की उपस्थिति में ओजोन चांदी को उच्च ऑक्साइड या Ag2O3 में ऑक्सीकृत करती है। उत्पादित सभी चांदी का लगभग 30-40% फिल्म और फोटोग्राफिक सामग्री के उत्पादन पर खर्च किया जाता है। चांदी का 20% सोना, पैलेडियम, तांबा या जस्ता के साथ मिश्र धातुओं के रूप में विद्युत इंजीनियरिंग और इलेक्ट्रॉनिक्स में संपर्क, सोल्डर, प्रवाहकीय परतों के निर्माण के लिए उपयोग किया जाता है। उत्पादित चांदी का 20-25% चांदी-जस्ता बैटरी के उत्पादन के लिए उपयोग किया जाता है। चांदी आधारित मिश्र धातु का उपयोग सिक्के, गहने, आभूषण और टेबलवेयर बनाने के लिए किया जाता है। घरेलू चांदी के उत्पादों में चांदी की सामग्री "नमूना" को दर्शाती है, एक मुहर मिश्र धातु में चांदी के बड़े अंश को दर्शाती है। चांदी का उपयोग चांदी के दर्पणों, खाद्य उद्योग में उपकरणों, ऑटोमोबाइल इंजनों में CO को जलाने के लिए उत्प्रेरक के रूप में, कार्बनिक संश्लेषण में NO कमी और ऑक्सीकरण प्रतिक्रियाओं के लिए किया जाता है। Cu, Au, Pb, Hg के साथ सिल्वर मिश्र धातु का उपयोग दंत चिकित्सा में भरने और कृत्रिम सामग्री के रूप में किया जाता है। सिल्वर नाइट्रेट AgNO3 दवा में पोटेशियम नाइट्रेट के साथ प्रयोग किया जाता है और इसे लैपिस कहा जाता है। कॉलरगोल (कोलॉइडल सिल्वर सॉल्यूशन) का उपयोग कसैले, दाग़ने वाले और एंटीसेप्टिक गुणों पर आधारित है। चांदी पौधों और जानवरों के जीवों का एक सूक्ष्म तत्व है। मानव शरीर में, चांदी की कुल सामग्री एक ग्राम के कुछ दसवें हिस्से के बराबर होती है। चांदी की शारीरिक भूमिका स्पष्ट नहीं है। चांदी के यौगिक जहरीले होते हैं। जब घुलनशील चांदी के लवण की बड़ी खुराक शरीर में प्रवेश करती है, तो तीव्र विषाक्तता होती है, साथ में जठरांत्र संबंधी मार्ग के म्यूकोसा का परिगलन होता है। चांदी जीवाणुनाशक है; 40-200 माइक्रोग्राम/ली पर, बीजाणु जीवाणु नहीं मरते हैं, लेकिन उच्च सांद्रता पर, बीजाणु जीवाणु।
यह ग्रीक शब्द अज़ूस से आया है - बेजान, लैटिन नाइट्रोजन में। नाइट्रोजन यौगिक - साल्टपीटर, नाइट्रिक एसिड, अमोनिया - नाइट्रोजन मुक्त अवस्था में प्राप्त होने से बहुत पहले जाने जाते थे। 1772 में, डी. रदरफोर्ड, एक कांच की घंटी में फॉस्फोरस और अन्य पदार्थों को जलाने से पता चला कि दहन के बाद बची हुई गैस, जिसे उन्होंने "घुटन भरी हवा" कहा, श्वसन और दहन का समर्थन नहीं करती है। 1787 में, ए. लैवोज़ियर ने स्थापित किया कि हवा बनाने वाली "महत्वपूर्ण" और "घुटन" गैसें सरल पदार्थ हैं, और उन्होंने "नाइट्रोजन" नाम का प्रस्ताव रखा। 1784 में, जी. कैवेंडिश ने दिखाया कि नाइट्रोजन साल्टपीटर का हिस्सा है। 1790 में, जे.ए. चैप्टल ने नाइट्रोजन के लिए लैटिन नाम प्रस्तावित किया (देर से लैटिन नाइट्रम से - साल्टपीटर और ग्रीक गेनाओ - मैं जन्म देता हूं, मैं उत्पादन करता हूं)। उन्नीसवीं सदी की शुरुआत तक। मुक्त अवस्था में नाइट्रोजन की रासायनिक जड़ता और बाध्य नाइट्रोजन के रूप में अन्य तत्वों के साथ यौगिकों में इसकी असाधारण भूमिका को स्पष्ट किया गया। नाइट्रोजन सौर मंडल में चौथा सबसे आम तत्व है (हाइड्रोजन, हीलियम और ऑक्सीजन के बाद) और पृथ्वी पर सबसे आम तत्वों में से एक है, जिसमें से अधिकांश (लगभग 4 * 10 15 टन) वातावरण में एक मुक्त अवस्था में केंद्रित है। हवा में, मुक्त नाइट्रोजन (एन 2 अणुओं के रूप में) मात्रा से 78.09% (या द्रव्यमान द्वारा 75.6%) है, अमोनिया और ऑक्साइड के रूप में मामूली अशुद्धियों की गिनती नहीं है। स्थलमंडल में नाइट्रोजन की औसत सामग्री वजन के हिसाब से 1.9 * 10 -3% है। बाध्य नाइट्रोजन की थोड़ी मात्रा कोयले (1 - 2.5%) और तेल (0.02 - 1.5%) के साथ-साथ नदियों, समुद्रों और महासागरों के पानी में पाई जाती है। नाइट्रोजन मिट्टी (0.1%) और जीवित जीवों (0.3%) में जमा होती है। यद्यपि "नाइट्रोजन" नाम का अर्थ "गैर-जीवन-निर्वाह" है, यह वास्तव में जीवन के लिए एक आवश्यक तत्व है। जानवरों और मनुष्यों के प्रोटीन में 16-17% नाइट्रोजन होता है। मांसाहारी जंतुओं के जीवों में प्रोटीन का निर्माण उन प्रोटीन पदार्थों के सेवन से होता है जो शाकाहारी जंतुओं के जीवों और पौधों में मौजूद होते हैं। पौधे मुख्य रूप से अकार्बनिक मिट्टी में निहित नाइट्रोजनयुक्त पदार्थों को आत्मसात करके प्रोटीन का संश्लेषण करते हैं। हवा से मुक्त नाइट्रोजन को नाइट्रोजन यौगिकों में परिवर्तित करने में सक्षम नाइट्रोजन-फिक्सिंग सूक्ष्मजीवों के कारण नाइट्रोजन की महत्वपूर्ण मात्रा मिट्टी में प्रवेश करती है। नाइट्रोजन हवा की तुलना में थोड़ा हल्का है; घनत्व 1.2506 किग्रा/एम3 (00С और 101325 एन/एम2 या 760 मिमी एचजी पर), टी पीएल -209.86 0 , टी किप -195.8 0 । नाइट्रोजन कठिनाई से द्रवित होता है: इसका महत्वपूर्ण तापमान काफी कम है (-147.10C) , और महत्वपूर्ण दबाव उच्च 3.39 एमएन / एम 2 (34.6 किग्रा / सेमी 2) है; तरल नाइट्रोजन का घनत्व 808 किग्रा / मी 3 है। नाइट्रोजन ऑक्सीजन की तुलना में पानी में कम घुलनशील है: 00C पर, 23.3 g नाइट्रोजन 1 m 3 H 2 O में घुल जाता है। पानी से बेहतर, नाइट्रोजन कुछ हाइड्रोकार्बन में घुलनशील है। आणविक नाइट्रोजन के विपरीत, सक्रिय नाइट्रोजन ऑक्सीजन, हाइड्रोजन, सल्फर वाष्प, फास्फोरस और कुछ धातुओं के साथ बहुत सख्ती से संपर्क करता है। नाइट्रोजन बहुत से महत्वपूर्ण कार्बनिक यौगिकों (एमाइन, अमीनो एसिड, नाइट्रो यौगिक, आदि) का एक हिस्सा है। निकाले गए मुक्त नाइट्रोजन का मुख्य भाग अमोनिया के औद्योगिक उत्पादन के लिए उपयोग किया जाता है, जिसे बाद में नाइट्रिक एसिड, उर्वरक, विस्फोटक आदि में महत्वपूर्ण मात्रा में संसाधित किया जाता है। तत्वों से अमोनिया के प्रत्यक्ष संश्लेषण के अलावा, साइनामाइड विधि विकसित हुई 1905, 1905 में विकसित, वायुमंडलीय नाइट्रोजन को ठीक करने के लिए औद्योगिक महत्व का है। इस तथ्य के आधार पर कि 1000 0 C पर कैल्शियम कार्बाइड मुक्त नाइट्रोजन के साथ प्रतिक्रिया करता है। कई उद्योगों में मुक्त नाइट्रोजन का उपयोग किया जाता है: विभिन्न रासायनिक और धातुकर्म प्रक्रियाओं में एक निष्क्रिय माध्यम के रूप में, ज्वलनशील तरल पदार्थ आदि को पंप करते समय पारा थर्मामीटर में खाली जगह भरने के लिए। तरल नाइट्रोजन का उपयोग विभिन्न प्रशीतन अनुप्रयोगों में किया जाता है। इसे स्टील देवर के जहाजों में संग्रहित और ले जाया जाता है।
(अव्य। आयोडियम)। आयोडीन की खोज 1811 में फ्रांसीसी रसायनज्ञ बी. कर्टोइस ने की थी। केंद्रित सल्फ्यूरिक एसिड के साथ समुद्री शैवाल की राख की माँ की नमकीन को गर्म करते हुए, उन्होंने एक वायलेट वाष्प (इसलिए नाम आयोडीन - ग्रीक आयोड से, आयोएड्स - बैंगनी, बैंगनी रंग के समान) की रिहाई को देखा, जो गहरे चमकदार के रूप में संघनित था। लैमेलर क्रिस्टल। 1813 - 1814 में फ्रांसीसी रसायनज्ञ जे.एल. गे-लुसाक और अंग्रेजी रसायनज्ञ जी। डेवी ने आयोडीन की मौलिक प्रकृति को साबित किया। पृथ्वी की पपड़ी में आयोडीन की औसत सामग्री वजन के हिसाब से 4*10-5% है। मेंटल और मैग्मा में और उनसे बनी चट्टानों (ग्रेनाइट, बेसाल्ट) में, आयोडीन यौगिक बिखरे हुए हैं; आयोडीन के गहरे खनिज अज्ञात हैं। पृथ्वी की पपड़ी में आयोडीन का इतिहास जीवित पदार्थ और बायोजेनिक प्रवास के साथ निकटता से जुड़ा हुआ है। जीवमंडल में, इसकी एकाग्रता की प्रक्रियाएं विशेष रूप से समुद्री जीवों (शैवाल, स्पंज) द्वारा देखी जाती हैं। आयोडीन के 8 ज्ञात सुपरजीन खनिज हैं जो जीवमंडल में बनते हैं, लेकिन वे बहुत दुर्लभ हैं। जीवमंडल के लिए आयोडीन का मुख्य भंडार विश्व महासागर है (औसतन 1 लीटर में 5 * 10-5 ग्राम आयोडीन होता है)। समुद्र से, समुद्र के पानी की बूंदों में घुले आयोडीन यौगिक वायुमंडल में प्रवेश करते हैं और हवाओं द्वारा महाद्वीपों तक ले जाते हैं। समुद्र से दूर या पहाड़ों द्वारा समुद्री हवाओं से घिरे क्षेत्रों में आयोडीन की कमी हो जाती है। आयोडीन मिट्टी और समुद्री गाद में कार्बनिक पदार्थों द्वारा आसानी से सोख लिया जाता है। इन गादों के संघनन और तलछटी चट्टानों के निर्माण के साथ, desorption होता है, आयोडीन के कुछ यौगिक भूजल में चले जाते हैं। इस प्रकार आयोडीन के निष्कर्षण के लिए उपयोग किए जाने वाले आयोडीन-ब्रोमीन पानी का निर्माण होता है, विशेष रूप से तेल क्षेत्रों के क्षेत्रों की विशेषता (कुछ स्थानों में 1 लीटर पानी में 100 मिलीग्राम से अधिक आयोडीन होता है)। 184.35 डिग्री सेल्सियस। आयोडीन पानी में खराब घुलनशील है (0.33 ग्राम / एल 25 डिग्री सेल्सियस पर), अच्छी तरह से - कार्बन डाइसल्फ़ाइड और कार्बनिक सॉल्वैंट्स (बेंजीन, अल्कोहल) में, साथ ही साथ आयोडाइड के जलीय घोल में। रासायनिक रूप से, आयोडीन काफी सक्रिय है, हालांकि क्लोरीन और ब्रोमीन की तुलना में कुछ हद तक। स्टार्च पर अधिशोषित आयोडीन इसे गहरे रंग में रंग देता है। नीला रंग; इसका उपयोग आयोडोमेट्री और आयोडीन का पता लगाने के लिए गुणात्मक विश्लेषण में किया जाता है। आयोडीन वाष्प जहरीले होते हैं और श्लेष्म झिल्ली को परेशान करते हैं। आयोडीन का त्वचा पर एक cauterizing और कीटाणुनाशक प्रभाव पड़ता है। आयोडीन के धब्बे सोडा या सोडियम थायोसल्फेट के घोल से धोए जाते हैं। रूस में आयोडीन के औद्योगिक उत्पादन के लिए कच्चा माल तेल ड्रिलिंग पानी है; विदेश में - समुद्री शैवाल, साथ ही चिली (सोडियम) नाइट्रेट के मातृ समाधान, जिसमें सोडियम आयोडेट के रूप में 0.4% आयोडीन होता है। तेल के पानी से आयोडीन निकालने के लिए (आमतौर पर आयोडीन के रूप में 20 - 40 मिलीग्राम / लीटर आयोडीन युक्त), उन्हें पहले क्लोरीन या नाइट्रस एसिड के साथ इलाज किया जाता है। जारी आयोडीन या तो सक्रिय कार्बन द्वारा सोख लिया जाता है या हवा के साथ उड़ा दिया जाता है। कोयले द्वारा अधिशोषित आयोडीन को कास्टिक क्षार या सोडियम सल्फाइट से उपचारित किया जाता है। आयोडीन और इसके यौगिकों का उपयोग मुख्य रूप से दवा और विश्लेषणात्मक रसायन विज्ञान के साथ-साथ कार्बनिक संश्लेषण और फोटोग्राफी में किया जाता है। उद्योग में, आयोडीन का उपयोग अभी भी मात्रा में नगण्य है, लेकिन बहुत ही आशाजनक है। इस प्रकार, उच्च शुद्धता वाली धातुओं का उत्पादन आयोडाइड्स के तापीय अपघटन पर आधारित होता है। आयोडीन जानवरों और मनुष्यों के लिए एक आवश्यक ट्रेस तत्व है। मिट्टी में आयोडीन की औसत सामग्री लगभग 3 * 10 -4%, पौधों में लगभग 2 * 10 -5% होती है। पीने के पानी में थोड़ा आयोडीन होता है (10 -7 से 10 -9% तक)। तटीय क्षेत्रों में, हवा के 1 मीटर 3 में आयोडीन की मात्रा 50 माइक्रोग्राम तक पहुंच सकती है, महाद्वीपीय और पहाड़ी क्षेत्रों में यह 1 या 0.2 माइक्रोग्राम भी है। पौधों द्वारा आयोडीन का अवशोषण मिट्टी में इसके यौगिकों की सामग्री और पौधों के प्रकार पर निर्भर करता है। कुछ जीव (समुद्री शैवाल - फुकस, केल्प, फाइलोफोरा, 1% आयोडीन तक जमा होते हैं, कुछ स्पंज - 8.5% तक)। आयोडीन को केंद्रित करने वाले शैवाल का उपयोग इसके औद्योगिक उत्पादन के लिए किया जाता है। आयोडीन भोजन, पानी, वायु के साथ पशु के शरीर में प्रवेश करता है। आयोडीन का मुख्य स्रोत पादप खाद्य पदार्थ और चारा है।
मानव शरीर में 20 से 50 मिलीग्राम आयोडीन जमा होता है, जिसमें मांसपेशियों में लगभग 10-25 मिलीग्राम और थायरॉयड ग्रंथि में 6-15 मिलीग्राम शामिल है। विभिन्न जैव रासायनिक प्रांतों में, दैनिक आहार में आयोडीन की मात्रा भिन्न होती है (एक व्यक्ति के लिए 20 से 240 माइक्रोग्राम, भेड़ के लिए 20 से 400 माइक्रोग्राम तक)। एक जानवर की आयोडीन की आवश्यकता उसकी शारीरिक अवस्था, मौसम, तापमान, पर्यावरण में आयोडीन की मात्रा के लिए शरीर के अनुकूलन पर निर्भर करती है। मनुष्यों और जानवरों में आयोडीन की दैनिक आवश्यकता लगभग 3 माइक्रोग्राम प्रति 1 किलो शरीर के वजन (गर्भावस्था के दौरान वृद्धि, वृद्धि में वृद्धि, शीतलन) है। शरीर में आयोडीन की शुरूआत बेसल चयापचय को बढ़ाती है, ऑक्सीडेटिव प्रक्रियाओं को बढ़ाती है, और मांसपेशियों को टोन करती है। भोजन और पानी में आयोडीन की अधिक या कम कमी के संबंध में, सामान्य नमक के आयोडाइजेशन का उपयोग किया जाता है, जिसमें आमतौर पर प्रति 1 टन नमक में 10-25 पोटेशियम आयोडाइड होता है। आयोडीन युक्त उर्वरकों के प्रयोग से फसलों में इसकी मात्रा दोगुनी और तिगुनी हो सकती है। आयोडीन युक्त दवाओं में जीवाणुरोधी और ऐंटिफंगलगुण, वे भी प्रदान करते हैं सूजनरोधीस्प्रूस और सेमोहक कार्रवाई; वे बाहरी रूप से घावों की कीटाणुशोधन, शल्य चिकित्सा क्षेत्र की तैयारी के लिए उपयोग किए जाते हैं। आयोडीन (माइक्रोआयोडीन) की छोटी खुराक थायरॉयड ग्रंथि के कार्य को बाधित करती है, पिट्यूटरी ग्रंथि के पूर्वकाल लोब में थायरॉयड-उत्तेजक हार्मोन के निर्माण पर कार्य करती है। चूंकि आयोडीन प्रोटीन और वसा (लिपिड) चयापचय को प्रभावित करता है, इसलिए इसे एथेरोस्क्लेरोसिस के उपचार में आवेदन मिला है, क्योंकि यह रक्त कोलेस्ट्रॉल को कम करता है; रक्त की फाइब्रिनोलिटिक गतिविधि को भी बढ़ाता है। आयोडीन के कृत्रिम रूप से रेडियोधर्मी समस्थानिक - 125 I, 131 I, 132 I और अन्य का व्यापक रूप से जीव विज्ञान में और विशेष रूप से चिकित्सा में थायरॉयड ग्रंथि की कार्यात्मक स्थिति का निर्धारण करने और इसके कई रोगों के इलाज के लिए उपयोग किया जाता है। निदान में रेडियोधर्मी आयोडीन का उपयोग थायरॉयड ग्रंथि में चुनिंदा रूप से जमा होने के लिए आयोडीन की क्षमता से जुड़ा है; औषधीय प्रयोजनों के लिए उपयोग ग्रंथि की स्रावी कोशिकाओं को नष्ट करने के लिए आयोडीन रेडियोआइसोटोप के बी-विकिरण की क्षमता पर आधारित है। जब पर्यावरण परमाणु विखंडन उत्पादों से दूषित होता है, तो आयोडीन के रेडियोधर्मी समस्थानिक जल्दी से जैविक चक्र में शामिल हो जाते हैं, अंततः दूध में मिल जाते हैं और, परिणामस्वरूप, मानव शरीर में। विशेष रूप से खतरनाक बच्चों के शरीर में उनका प्रवेश है, जिनकी थायरॉयड ग्रंथि वयस्कों की तुलना में 10 गुना छोटी है और इसके अलावा, अधिक रेडियोसक्रियता है। थायरॉयड ग्रंथि में आयोडीन के रेडियोधर्मी समस्थानिकों के जमाव को कम करने के लिए, स्थिर I. तैयारी (प्रति खुराक 100-200 मिलीग्राम) का उपयोग करने की सिफारिश की जाती है। रेडियोधर्मी आयोडीन जठरांत्र संबंधी मार्ग में तेजी से और पूरी तरह से अवशोषित होता है और थायरॉयड ग्रंथि में चुनिंदा रूप से जमा होता है। इसका अवशोषण ग्रंथि की कार्यात्मक अवस्था पर निर्भर करता है।
5.कोबाल्ट
(अव्य। कोबाल्टम)। धातु का नाम जर्मन कोबोल्ड (ब्राउनी, बौना) से आया है। कोबाल्ट यौगिकों को प्राचीन काल में जाना और इस्तेमाल किया जाता था। 15वीं शताब्दी के मिस्र के कांच के जार को संरक्षित किया गया है। ईसा पूर्व, कोबाल्ट लवण के साथ चित्रित, साथ ही कोबाल्ट युक्त नीली कांच की ईंटें। प्राचीन असीरिया में, साथ ही बाबुल में, लैपिस लाजुली कोबाल्ट से बनाया गया था - एक नीला रंग जिसे मिट्टी के बर्तनों पर डाला जाता था। कोबाल्ट यौगिकों को प्राप्त करने के लिए प्रारंभिक सामग्री तब ज़फ़र (ज़फ़र)-नीलम थी जिसमें बिस्मथ और कोबाल्ट होता था; पेंट के नाम कहां से आए - कुसुम, केसर, आदि। मध्य युग में, खनिकों को अन्य अयस्कों के साथ कोबाल्ट "पृथ्वी" मिला, लेकिन यह नहीं पता था कि इसका क्या करना है। कभी-कभी यह पृथ्वी चांदी के अयस्क की तरह दिखती थी, लेकिन इसमें चांदी नहीं होती थी। मध्य युग में, जर्मन खनिक, कोबाल्ट भूमि के गुणों पर जोर देना चाहते थे, उन्हें कोबोल्ड कहते थे - एक भूमिगत सूक्ति, एक नकली आत्मा, एक बेईमान बदमाश। कोबाल्ट का उल्लेख 15वीं-17वीं शताब्दी के बिरिंगुशियो, वासिली वैलेंटाइनस, पैरासेल्सस और अन्य लेखकों द्वारा किया गया है। रूलैंड का "अलकेमिकल लेक्सिकॉन" (1612) कोबाल्ट के बारे में कहता है: "कोबोल, कोबाल्ट (कोबोलटम, कोबाल्टम) या कोलेट (कोलेटम) एक धातु पदार्थ है, जो सीसा और लोहे की तुलना में काला होता है, गर्म होने पर फैलता है।" कोबाल्ट एक काला पदार्थ है, जो राख के रंग से थोड़ा मिलता-जुलता है, जिसे जाली और कास्ट किया जा सकता है, लेकिन इसमें धातु की चमक नहीं होती है, और जो एक हानिकारक निलंबन है जो धुएं के साथ अच्छे अयस्क को (जब पिघलाया जाता है) निकाल देता है। फिर भी, रसायन विज्ञान के इतिहास में, यह आमतौर पर स्वीकार किया जाता है कि धातु कोबाल्ट का वर्णन पहली बार 1735 में प्रोफेसर ब्रांट द्वारा किया गया था। अपने शोध प्रबंध "ऑन सेमीमेटल्स" में, ब्रांट बताते हैं कि अयस्कों से प्राप्त धातु बिस्मथ शुद्ध धातु नहीं है, लेकिन इसमें "कोबाल्ट बीटल" (धातु कोबाल्ट) होता है। उन्होंने यह भी पाया कि कोबाल्ट लवण काँच के नीले रंग का होता है। अपने शुद्ध रूप में, धात्विक कोबाल्ट Verzelius द्वारा प्राप्त किया गया था। 18 वीं और के रूसी साहित्य में प्रारंभिक XIXमें। कोबोल्ट, कोबोल्ट (सोलोविएव और स्ट्रैखोव, 1824 और रसायन विज्ञान पर पहले के कार्यों में) नाम हैं। द्विगुब्स्की (1824) कोबाल्ट नाम का प्रयोग करता है; बाद में इसे आम तौर पर स्वीकार कर लिया जाता है। इसका घनत्व 8.9 ग्राम / सेमी 3, गलनांक - 1494 डिग्री सेल्सियस है, इसमें फेरोमैग्नेटिक गुण (क्यूरी पॉइंट 1121 डिग्री सेल्सियस) है। हवा में सामान्य तापमान पर, यह रासायनिक रूप से प्रतिरोधी है। द्वारा रासायनिक संरचनाकोबाल्ट अयस्क के तीन मुख्य प्रकार हैं: आर्सेनिक अयस्क, सल्फरस और ऑक्सीकृत। 1 टन अयस्क से 1 से 30 किग्रा कोबाल्ट प्राप्त होता है। लौह उपसमूह की धातुओं में, कोबाल्ट सबसे दुर्लभ है; पृथ्वी की पपड़ी में इसकी सामग्री एक प्रतिशत के हजारवें हिस्से से अधिक नहीं है। कुल विश्व भंडार का अनुमान 6 मिलियन टन है, और उनमें से अधिकांश विदेशों में केंद्रित हैं: ज़ैरे, मोरक्को, ज़ाम्बिया, आदि। रूस में, कोबाल्ट अयस्कों का सबसे बड़ा भंडार नोरिल्स्क है, और अज़रबैजान के पास गणराज्यों से महत्वपूर्ण भंडार हैं। पूर्व यूएसएसआर रासायनिक उद्योग में, धातु यह मुख्य रूप से विभिन्न रासायनिक प्रक्रियाओं के लिए उत्प्रेरक के रूप में उपयोग किया जाता है। सुखाने की प्रक्रिया को तेज करने के लिए पेंट और वार्निश में कोबाल्ट लवण मिलाए जाते हैं। कोबाल्ट का एक महत्वपूर्ण जैविक महत्व है, यह जैविक रूप से सक्रिय तत्वों में से एक है और हमेशा जानवरों और पौधों के शरीर में पाया जाता है। मिट्टी और पौधों में इसकी अपर्याप्त सामग्री के साथ, जानवरों में एनीमिया का विकास जुड़ा हुआ है। पानी में घुलनशील विटामिन बी 12 के हिस्से के रूप में, कोबाल्ट का नाइट्रोजनयुक्त पदार्थों के सेवन पर बहुत सक्रिय प्रभाव पड़ता है, क्लोरोफिल और एस्कॉर्बिक एसिड की सामग्री में वृद्धि होती है। यह विटामिन कार्बोहाइड्रेट और वसा चयापचय को प्रभावित करता है; हेमटोपोइजिस में भाग लेता है सूक्ष्म खुराक में, कोबाल्ट कई पौधों और जानवरों के सामान्य कामकाज के लिए एक आवश्यक तत्व है। हालांकि, कोबाल्ट यौगिकों की उच्च सांद्रता विषाक्त होती है। वर्तमान में भारी धातुओं के लवणों से पर्यावरण प्रदूषण की गंभीर समस्या है।
6. सिलिकॉन
(अव्य। सिलेक्स - चकमक पत्थर से सिलिकियम)। प्राचीन काल से सिलिकॉन यौगिकों को मनुष्य के लिए जाना जाता है। लेकिन एक साधारण पदार्थ के साथ सिलिकॉन आदमी लगभग 200 साल पहले ही मिला था। वास्तव में, सिलिकॉन प्राप्त करने वाले पहले शोधकर्ता फ्रांसीसी जे.एल. गे-लुसाक और एल.जे. थेनार। 1811 में उन्होंने पाया कि धात्विक पोटेशियम के साथ सिलिकॉन फ्लोराइड को गर्म करने से भूरा-भूरा पदार्थ बनता है, लेकिन शोधकर्ताओं ने स्वयं एक नया सरल पदार्थ प्राप्त करने के बारे में सही निष्कर्ष नहीं निकाला। एक नए तत्व की खोज करने का सम्मान स्वीडिश रसायनज्ञ जे। बर्ज़ेलियस का है, जिन्होंने सिलिकॉन प्राप्त करने के लिए, K2SiF6 संरचना के एक यौगिक को पोटेशियम धातु के साथ गर्म किया। उन्होंने फ्रांसीसी रसायनज्ञों के समान अनाकार पाउडर प्राप्त किया, और 1824 में एक नए मौलिक पदार्थ की घोषणा की, जिसे उन्होंने "सिलिकॉन" कहा। क्रिस्टलीय सिलिकॉन केवल 1854 में फ्रांसीसी रसायनज्ञ ए.ई. सेंट क्लेयर डेविल। पृथ्वी की पपड़ी में व्यापकता के संदर्भ में, सिलिकॉन सभी तत्वों (ऑक्सीजन के बाद) में दूसरे स्थान पर है। सिलिकॉन पृथ्वी की पपड़ी के द्रव्यमान का 27.7% है। सिलिकॉन कई सौ विभिन्न प्राकृतिक सिलिकेट्स और एल्युमिनोसिलिकेट्स का एक घटक है। सिलिका, या सिलिकॉन डाइऑक्साइड SiO2 (नदी की रेत, क्वार्ट्ज, चकमक पत्थर, आदि), भी व्यापक है, जो पृथ्वी की पपड़ी (द्रव्यमान के अनुसार) का लगभग 12% है। प्रकृति में सिलिकॉन मुक्त रूप में नहीं पाया जाता है। उद्योग में, चाप भट्टियों में लगभग 1800°C के तापमान पर कोक के साथ SiO2 पिघले हुए SiO2 को कम करके सिलिकॉन प्राप्त किया जाता है। इस प्रकार प्राप्त सिलिकॉन की शुद्धता लगभग 99.9% है। चूंकि व्यावहारिक उपयोग के लिए उच्च शुद्धता के सिलिकॉन की आवश्यकता होती है, परिणामस्वरूप सिलिकॉन क्लोरीनयुक्त होता है। संरचना के यौगिक SiCl4 तथा SiCl3H बनते हैं। ये क्लोराइड आगे शुद्ध करते हैं विभिन्न तरीकेअशुद्धियों से और, अंतिम चरण में, शुद्ध हाइड्रोजन के साथ कम किया जाता है। प्रारंभिक रूप से मैग्नीशियम सिलिकाइड Mg2Si प्राप्त करके सिलिकॉन को शुद्ध करना भी संभव है। इसके अलावा, हाइड्रोक्लोरिक या एसिटिक एसिड का उपयोग करके मैग्नीशियम सिलिकाइड से वाष्पशील मोनोसिलेन SiH4 प्राप्त किया जाता है। मोनोसिलेन को आसवन, सोखना और अन्य तरीकों से और शुद्ध किया जाता है, और फिर लगभग 1000 डिग्री सेल्सियस के तापमान पर सिलिकॉन और हाइड्रोजन में विघटित किया जाता है। इन विधियों द्वारा प्राप्त सिलिकॉन में अशुद्धियों की मात्रा वजन से 10-8-10-6% तक कम हो जाती है। सिलिकॉन की क्रिस्टल जाली हीरे के प्रकार का चेहरा-केंद्रित घन है (सिलिकॉन के अन्य बहुरूपी संशोधन भी उच्च दबाव पर प्राप्त किए गए थे), लेकिन लंबाई की तुलना में सी-सी परमाणुओं के बीच लंबी बंधन लंबाई के कारण सी-सी कनेक्शनसिलिकॉन हीरे की तुलना में बहुत कम कठोर होता है। सिलिकॉन का घनत्व 2.33 किग्रा/डीएम3 है। गलनांक 1410°C, क्वथनांक 2355°C। सिलिकॉन भंगुर होता है, केवल 800 डिग्री सेल्सियस से ऊपर गर्म होने पर ही यह प्लास्टिक बन जाता है। दिलचस्प है, सिलिकॉन अवरक्त विकिरण के लिए पारदर्शी है। मौलिक सिलिकॉन एक विशिष्ट अर्धचालक है। कमरे के तापमान पर आंतरिक चालकता के साथ सिलिकॉन में वर्तमान वाहक की एकाग्रता 1.5 1016 मीटर -3 है। क्रिस्टलीय सिलिकॉन के विद्युत गुण इसमें निहित सूक्ष्म अशुद्धियों से बहुत प्रभावित होते हैं। रासायनिक रूप से, सिलिकॉन निष्क्रिय है। कमरे के तापमान पर, यह वाष्पशील सिलिकॉन टेट्राफ्लोराइड SiF4 बनाने के लिए केवल गैसीय फ्लोरीन के साथ प्रतिक्रिया करता है। 400-500 डिग्री सेल्सियस के तापमान पर गर्म होने पर, सिलिकॉन ऑक्सीजन के साथ प्रतिक्रिया करके SiO2 डाइऑक्साइड बनाता है।
सिलिकॉन डाइऑक्साइड SiO2 एक अम्लीय ऑक्साइड है जो पानी के साथ प्रतिक्रिया नहीं करता है। यह कई बहुरूपी संशोधनों (क्वार्ट्ज, ट्राइडीमाइट, क्रिस्टोबालाइट, ग्लासी SiO2) के रूप में मौजूद है। इन संशोधनों में से, क्वार्ट्ज का सबसे बड़ा व्यावहारिक मूल्य है। क्वार्ट्ज पराबैंगनी विकिरण के लिए पारदर्शी है। यह थर्मल विस्तार के बहुत कम गुणांक की विशेषता है, इसलिए क्वार्ट्ज से बने व्यंजन 1000 डिग्री तक के तापमान में गिरावट नहीं करते हैं। सिलिकॉन का उपयोग अर्धचालक पदार्थ के रूप में किया जाता है। क्वार्ट्ज का उपयोग गर्मी प्रतिरोधी रासायनिक (क्वार्ट्ज) व्यंजन, यूवी लैंप के निर्माण के लिए एक सामग्री के रूप में किया जाता है। सिलिकेट का व्यापक रूप से निर्माण सामग्री के रूप में उपयोग किया जाता है। खिड़की के शीशे अनाकार सिलिकेट हैं। सिलिकॉन सामग्री को उच्च पहनने के प्रतिरोध की विशेषता है और व्यापक रूप से सिलिकॉन तेल, चिपकने वाले, घिसने और वार्निश के रूप में उपयोग किया जाता है। कुछ जीवों के लिए, सिलिकॉन एक महत्वपूर्ण बायोजेनिक तत्व है। यह पौधों में सहायक संरचनाओं और जानवरों में कंकाल संरचनाओं का हिस्सा है। बड़ी मात्रा में, सिलिकॉन समुद्री जीवों द्वारा केंद्रित होता है - डायटम, रेडिओलेरियन, स्पंज। मानव मांसपेशी ऊतक में (1-2) 10-2% सिलिकॉन, हड्डी के ऊतक - 17 10-4%, रक्त - 3.9 मिलीग्राम / एल होते हैं। भोजन के साथ, प्रति दिन 1 ग्राम तक सिलिकॉन मानव शरीर में प्रवेश करता है। सिलिकॉन यौगिक जहरीले नहीं होते हैं। लेकिन सिलिकेट और सिलिकॉन डाइऑक्साइड दोनों के बारीक छितरे हुए कणों को अंदर लेना बहुत खतरनाक है, जो बनते हैं, उदाहरण के लिए, ब्लास्टिंग के दौरान, जब खदानों में चट्टानों को चीरते हुए, सैंडब्लास्टिंग मशीनों के संचालन के दौरान, आदि। SiO2 माइक्रोपार्टिकल्स जो फेफड़ों में प्रवेश करते हैं, क्रिस्टलीकृत हो जाते हैं उन्हें, और परिणामस्वरूप क्रिस्टल फेफड़े के ऊतकों को नष्ट कर देते हैं और एक गंभीर बीमारी का कारण बनते हैं - सिलिकोसिस। इस खतरनाक धूल को फेफड़ों में प्रवेश करने से रोकने के लिए, श्वसन सुरक्षा के लिए एक श्वासयंत्र का उपयोग किया जाना चाहिए।
(अव्य। बिस्मुथम)। बिस्मथ को 15वीं शताब्दी के बाद से जाना जाता है, लेकिन लंबे समय से इसे विभिन्न प्रकार के टिन, सीसा, या सुरमा के लिए गलत माना जाता था। 1529 में, खनन और धातु विज्ञान के क्षेत्र में एक जर्मन वैज्ञानिक जी. एग्रीकोला ने धातु विस्मुट, इसके निष्कर्षण और प्रसंस्करण के बारे में पहली जानकारी दी। बिस्मथ की रासायनिक पहचान पहली बार 1739 में आई. पोट द्वारा स्थापित की गई थी। 1819 में स्वीडिश रसायनज्ञ जे. बर्ज़ेलियस द्वारा रासायनिक नामकरण में पेश किया गया। आवर्त सारणी में, बिस्मथ अंतिम स्थिर (गैर-रेडियोधर्मी) तत्व है। कुछ रिपोर्टों के अनुसार, 209Bi कमजोर रूप से रेडियोधर्मी है, लेकिन इसका आधा जीवन इतना लंबा (लगभग 1017 वर्ष) है कि इस न्यूक्लाइड को स्थिर माना जा सकता है। पृथ्वी की पपड़ी में बिस्मथ की मात्रा बहुत कम है और केवल 9·10-7% (सभी तत्वों में 71वां स्थान) है। प्रकृति में, यह कभी-कभी मुक्त रूप में पाया जाता है। बिस्मथ एक दुर्लभ ट्रेस तत्व है, इसके अपने खनिज बहुत दुर्लभ हैं। गलनांक 271.4°C (बिस्मथ सबसे अधिक गलने योग्य धातुओं में से एक है), क्वथनांक 1564°C, घनत्व 9.80 kg/dm3। पिघलते समय, बिस्मथ का आयतन (बर्फ की तरह) कम हो जाता है, अर्थात ठोस बिस्मथ तरल से हल्का होता है। उच्च दबाव पर, धातु विस्मुट के अन्य संशोधन होते हैं। बिस्मथ भंगुर होता है और इसे आसानी से पाउडर बनाया जा सकता है। बिस्मथ धातुओं में सबसे मजबूत हीरा है। शुष्क हवा में, बिस्मथ ऑक्सीकरण नहीं करता है, नम वातावरण में, यह धीरे-धीरे ऑक्साइड की एक फिल्म के साथ कवर हो जाता है। जब 1000°C से ऊपर गर्म किया जाता है, तो यह मूल ऑक्साइड Bi2O3 के निर्माण के साथ जल जाता है। बिस्मथ का स्रोत सीसा, टिन और अन्य अयस्क हैं, जहां यह अशुद्धता के रूप में निहित है। बिस्मथ के औद्योगिक उत्पादन में, पहले सीसा और तांबे के अयस्कों से एक सांद्रण तैयार किया जाता है (बिस्मथ सामग्री जिसमें आमतौर पर दसवां और एक प्रतिशत का सौवां हिस्सा होता है)। सांद्रों को हाइड्रोमेटेलर्जिकल साधनों द्वारा संसाधित किया जाता है, कभी-कभी उन्हें मेटालोथर्मिक उपचार (कैल्शियम या मैग्नीशियम को कम करने वाले एजेंटों के रूप में उपयोग करके) के अधीन किया जाता है। बिस्मथ के शुद्धिकरण के अंतिम चरण में, निष्कर्षण, विभिन्न रासायनिक और विद्युत रासायनिक विधियों का उपयोग किया जाता है। रूस में, 1918 में K. A. Nenadkevich द्वारा पहला किलोग्राम धात्विक बिस्मथ प्राप्त किया गया था, जिन्होंने इसे गलाने की तकनीक विकसित की थी। बिस्मथ का मुख्य अनुप्रयोग फ्यूसिबल मिश्र धातुओं के एक घटक के रूप में इसका उपयोग है। बिस्मथ शामिल है, उदाहरण के लिए, प्रसिद्ध लकड़ी के मिश्र धातु में, जिसका गलनांक पानी के क्वथनांक से नीचे होता है, कई अन्य मिश्र धातुओं में, उदाहरण के लिए, फ़्यूज़िबल फ़्यूज़ के निर्माण में। बिस्मथ और मैंगनीज के मिश्र लौह चुंबकीय गुणों की विशेषता है और इसलिए शक्तिशाली स्थायी चुंबक के निर्माण के लिए जाते हैं। बिस्मथ यौगिकों, विशेष रूप से Bi2O3, का उपयोग ग्लासमेकिंग और सिरेमिक में, दवा उद्योग में, उत्प्रेरक के रूप में, आदि में किया जाता है।
(अव्य। हीलियम)। हीलियम की खोज 1868 में शुरू हुई, जब एक सूर्य ग्रहण को देखते हुए, फ्रांसीसी खगोलविद पी.जे.एच. जानसेन और अंग्रेज डी.एन. लॉकयर ने स्वतंत्र रूप से सौर कोरोना के स्पेक्ट्रम में एक पीली रेखा की खोज की (इसे डी 3 लाइन कहा जाता था), जिसे उस समय ज्ञात किसी भी तत्व के लिए जिम्मेदार नहीं ठहराया जा सकता था। 1871 में, लॉकयर ने सूर्य पर एक नए तत्व की उपस्थिति से इसकी उत्पत्ति की व्याख्या की। 1895 में, अंग्रेज डब्ल्यू. रामसे ने प्राकृतिक रेडियोधर्मी अयस्क क्लेवेट से एक गैस को अलग किया, जिसके स्पेक्ट्रम में वही डी3 लाइन मौजूद थी। लॉकयर ने नए तत्व को उसकी खोज के इतिहास (ग्रीक हेलिओस, सूर्य) को दर्शाते हुए एक नाम दिया। चूंकि लॉकयर का मानना था कि खोजा गया तत्व एक धातु था, उन्होंने तत्व के लैटिन नाम में समाप्त होने वाले "लिम" का इस्तेमाल किया, जो आमतौर पर धातुओं के नाम पर प्रयोग किया जाता है। इस प्रकार, हीलियम, पृथ्वी पर अपनी खोज से बहुत पहले, एक ऐसा नाम प्राप्त हुआ जो इसे अंत के साथ अन्य अक्रिय गैसों के नामों से अलग करता है। वायुमंडलीय हवा में हीलियम की मात्रा बहुत कम होती है और आयतन के हिसाब से लगभग 5.27 10-4% होती है। पृथ्वी की पपड़ी में यह 0.8 10-6%, समुद्र के पानी में - 4 10-10% है। हीलियम का स्रोत तेल और हीलियम-असर वाली प्राकृतिक गैसें हैं, जिसमें हीलियम की मात्रा 2-3% तक पहुँच जाती है, और दुर्लभ मामलों में मात्रा के हिसाब से 8-10%। लेकिन अंतरिक्ष में, हीलियम दूसरा सबसे आम तत्व है (हाइड्रोजन के बाद): यह ब्रह्मांडीय द्रव्यमान का 28% हिस्सा है। वर्तमान में, हीलियम को गहरी शीतलन विधि का उपयोग करके प्राकृतिक हीलियम-असर वाली गैसों से अलग किया जाता है (हीलियम को अन्य सभी गैसों की तुलना में निकालना अधिक कठिन होता है)। रूस, अमेरिका, कनाडा और दक्षिण अफ्रीका में ऐसी गैसों के भंडार हैं। हीलियम कुछ खनिजों (मोनाजाइट, थोरियनाइट, और अन्य) में भी निहित है, जबकि 1 किलो खनिज से, गर्म होने पर, 10 लीटर तक हीलियम को अलग किया जा सकता है। हीलियम एक हल्की गैर-दहनशील गैस है, सामान्य परिस्थितियों में गैसीय हीलियम का घनत्व 0.178 किग्रा/घनमीटर है (केवल हाइड्रोजन गैस कम है)। हीलियम का क्वथनांक (सामान्य दाब पर) लगभग 4.2K (या -268.93°C, जो सबसे कम क्वथनांक होता है) होता है। सामान्य दबाव में, तरल हीलियम को पूर्ण शून्य (0K) के करीब तापमान पर भी ठोस में नहीं बदला जा सकता है। लगभग 3.76 MPa के दाब पर हीलियम का गलनांक 2.0K होता है। सबसे कम दबाव जिस पर तरल हीलियम का ठोस अवस्था में संक्रमण देखा जाता है, वह 2.5 MPa (25 atm) है, हीलियम का गलनांक लगभग 1.1 K (-272.1 ° C) होता है। 0.86 मिली हीलियम 20 डिग्री सेल्सियस पर 100 मिली पानी में घुल जाता है, कार्बनिक सॉल्वैंट्स में इसकी घुलनशीलता और भी कम होती है। हीलियम लेजर वातावरण के एक घटक के रूप में, रॉकेट ईंधन को पंप करते समय, हवाई जहाजों और गुब्बारों को भरने के लिए वेल्डिंग, काटने और धातुओं को पिघलाने के लिए एक निष्क्रिय और सुरक्षात्मक वातावरण बनाने के लिए हीलियम का उपयोग किया जाता है। तरल हीलियम, पृथ्वी पर सबसे ठंडा तरल, प्रायोगिक भौतिकी में एक अनूठा सर्द है, जो वैज्ञानिक अनुसंधान में अति-निम्न तापमान के उपयोग की अनुमति देता है (उदाहरण के लिए, विद्युत अतिचालकता के अध्ययन में)। इस तथ्य के कारण कि हीलियम रक्त में बहुत खराब घुलनशील है, इसका उपयोग गोताखोरों को सांस लेने के लिए आपूर्ति की जाने वाली कृत्रिम हवा के एक अभिन्न अंग के रूप में किया जाता है। हीलियम के साथ नाइट्रोजन को बदलने से डीकंप्रेसन बीमारी से बचाव होता है (जब साधारण हवा में साँस ली जाती है, तो नाइट्रोजन उच्च दबाव में रक्त में घुल जाता है, और फिर उसमें से बुलबुले के रूप में निकल जाता है जो छोटे जहाजों को रोकते हैं)।
ब्रोमीन की खोज का नेतृत्व फ्रांसीसी रसायनज्ञ ए। बालार्ड के अध्ययन ने किया था, जिन्होंने 1825 में समुद्री शैवाल की राख को धोने के बाद प्राप्त जलीय घोल पर क्लोरीन के साथ अभिनय करके एक गहरे भूरे, दुर्गंध वाले तरल को अलग किया था। उन्होंने इस तरल को समुद्र के पानी से भी प्राप्त किया, म्यूराइड (लैटिन मुरिया से - नमक का घोल, नमकीन) और पेरिस एकेडमी ऑफ साइंसेज को अपनी खोज के बारे में एक संदेश भेजा। इस रिपोर्ट को सत्यापित करने के लिए गठित आयोग ने बलार नाम को स्वीकार नहीं किया और नए तत्व ब्रोमीन का नाम रखा। ब्रोमीन की खोज ने युवा और अल्पज्ञात वैज्ञानिक को प्रसिद्ध बना दिया। बालर के लेख की उपस्थिति के बाद, यह पता चला कि एक समान पदार्थ वाले फ्लास्क जर्मन रसायनज्ञ के। लेविग और जे। लिबिग द्वारा शोध की प्रतीक्षा कर रहे थे। ब्रोमीन पृथ्वी की पपड़ी में काफी दुर्लभ तत्व है। इसमें इसकी सामग्री 0.37 10-4% (लगभग 50 वां स्थान) अनुमानित है। रासायनिक रूप से, ब्रोमीन अत्यधिक सक्रिय है और इसलिए प्रकृति में मुक्त रूप में नहीं होता है। बड़ी संख्या में विभिन्न यौगिकों में शामिल हैं। ब्रोमीन के अपने खनिज - ब्रोमार्जाइराइट (सिल्वर ब्रोमाइड एजीबीआर) और एम्बोलाइट (सिल्वर क्लोराइड और ब्रोमाइड) - अत्यंत दुर्लभ हैं। ब्रोमीन का स्रोत कड़वी झीलों का पानी, तेल से जुड़ी नमक की नमकीन और विभिन्न नमक जमा, और समुद्र का पानी (65 10-4%), मृत सागर ब्रोमीन में समृद्ध है। वर्तमान में, ब्रोमीन आमतौर पर कुछ कड़वी झीलों के पानी से निकाला जाता है, जिनमें से एक हमारे देश में कुलुंडा स्टेपी (अल्ताई) में स्थित है। सामान्य परिस्थितियों में, ब्रोमीन एक भारी (घनत्व 3.1055 ग्राम/सेमी3) लाल-भूरे रंग का गाढ़ा तरल होता है जिसमें तीखी गंध होती है। ब्रोमीन इनमें से एक है सरल पदार्थ, सामान्य परिस्थितियों में तरल। ब्रोमीन का गलनांक -7.25°C, क्वथनांक +59.2°C होता है। यह द्विपरमाणुक Br2 अणुओं के रूप में मुक्त रूप में विद्यमान है। परमाणुओं में अणुओं का ध्यान देने योग्य पृथक्करण 800 डिग्री सेल्सियस के तापमान पर देखा जाता है और तापमान में और वृद्धि के साथ तेजी से बढ़ता है। ब्रोमीन थोड़ा है, लेकिन अन्य हैलोजन से बेहतर है, पानी में घुलनशील (20 डिग्री सेल्सियस पर 100 ग्राम पानी में 3.58 ग्राम)। ब्रोमीन जल में अभिक्रिया हाइड्रोब्रोमिक अम्ल के निर्माण के साथ आगे बढ़ती है। ब्रोमीन का उपयोग कई अकार्बनिक और की तैयारी में किया जाता है कार्बनिक पदार्थ, विश्लेषणात्मक रसायन विज्ञान में। ब्रोमीन यौगिकों का उपयोग ईंधन योजक, कीटनाशक, ज्वाला मंदक और फोटोग्राफी में किया जाता है। ब्रोमीन युक्त दवाएं व्यापक रूप से जानी जाती हैं। ब्रोमीन की तैयारी का शामक प्रभाव केंद्रीय तंत्रिका तंत्र में अवरोध की प्रक्रियाओं को बढ़ाने की उनकी क्षमता पर आधारित है। ब्रोमीन के साथ काम करते समय सुरक्षात्मक कपड़े, गैस मास्क और दस्ताने का उपयोग किया जाना चाहिए। ब्रोमीन वाष्प का MPC 0.5 mg/m3 है। पहले से ही लगभग 0.001% (मात्रा से) की एकाग्रता में हवा में ब्रोमीन की एकाग्रता में, श्लेष्म झिल्ली की जलन, चक्कर आना, और उच्च सांद्रता में - श्वसन पथ की ऐंठन, घुटन देखी जाती है। जब अंतर्ग्रहण किया जाता है, तो विषाक्त खुराक 3 ग्राम होती है, घातक खुराक 35 ग्राम से होती है। ब्रोमीन वाष्प और तरल ब्रोमीन दोनों की उच्च रासायनिक गतिविधि और विषाक्तता के कारण, इसे एक गिलास, कसकर सील मोटी दीवार वाले कंटेनर में संग्रहित किया जाना चाहिए।
ब्रोमीन के साथ शीशियों को रेत के साथ कंटेनरों में रखा जाता है, जो हिलने पर फ्लास्क को विनाश से बचाता है।
ब्रोमीन का घनत्व अधिक होने के कारण इसकी बोतलों को कभी भी गले से नहीं लगाना चाहिए।
बिखरे हुए ब्रोमीन को बेअसर करने के लिए, इसके साथ सतह को तुरंत गीले Na2CO3 सोडा के घोल से ढक देना चाहिए।
10. फास्फोरस
(अव्य। - फास्फोरस)। फॉस्फोरस पहली बार 1669 में हैम्बर्ग कीमियागर एच। ब्रांड द्वारा मुक्त अवस्था में प्राप्त किया गया था (इस बात का प्रमाण है कि गुणों में समान पदार्थ 12 वीं शताब्दी में अरब कीमियागर बहिल द्वारा प्राप्त किया गया था)। दार्शनिक के पत्थर की तलाश में, उन्होंने एक बंद बर्तन में नदी की रेत और लकड़ी का कोयला के साथ मूत्र के वाष्पीकरण से सूखे अवशेषों को शांत किया। कैल्सीनेशन के बाद, अभिकर्मकों वाला बर्तन सफेद रोशनी के साथ अंधेरे में चमकने लगा (यह मूत्र में निहित यौगिकों से कम फॉस्फोरस था)। 1680 में, फॉस्फोरस अंधेरे में चमक रहा था (ग्रीक "फॉस्फोरस" से - चमकदार) अंग्रेज आर। बॉयल द्वारा प्राप्त किया गया था। बाद के वर्षों में, यह पाया गया कि फास्फोरस न केवल मूत्र में, बल्कि मस्तिष्क के ऊतकों में, कंकाल की हड्डियों में भी होता है। कोयले के साथ अस्थि राख को शांत करके फास्फोरस प्राप्त करने की सबसे सरल विधि 1771 में के. शीले द्वारा प्रस्तावित की गई थी। फॉस्फोरस की तात्विक प्रकृति की स्थापना 18वीं शताब्दी के अंत में ए.एल. लैवोजियर द्वारा की गई थी। पृथ्वी की पपड़ी में सामग्री द्रव्यमान से 0.105% है, जो सामग्री से काफी अधिक है, उदाहरण के लिए, नाइट्रोजन। समुद्र के पानी में 0.07 मिलीग्राम/ली. फॉस्फोरस प्रकृति में मुक्त रूप में नहीं पाया जाता है, बल्कि यह 200 विभिन्न खनिजों का हिस्सा है। फास्फोरस सभी जीवों में पाया जाता है। मौलिक फास्फोरस कई एलोट्रोपिक संशोधनों में मौजूद है, जिनमें से मुख्य हैं: सफेद (फास्फोरस III), लाल (फास्फोरस II) और काला (फास्फोरस I)। सफेद फास्फोरस एक विशिष्ट गंध के साथ एक मोमी, पारदर्शी पदार्थ है। टेट्राहेड्रल P4 अणुओं से मिलकर बनता है जो स्वतंत्र रूप से घूम सकता है। सफेद फास्फोरस में एक घन आणविक-प्रकार की क्रिस्टल जाली होती है। घनत्व 1.828 किग्रा/डीएम3. गलनांक 44.14°C, क्वथनांक 287°C। सफेद फास्फोरस के दो रूप हैं: ए-संशोधन, एक घन क्रिस्टल जाली के साथ, -76.9 डिग्री सेल्सियस पर बी-संशोधन में गुजरता है, जिसकी क्रिस्टल जाली स्थापित नहीं की गई है और पी 4 अणुओं का कोई मुक्त रोटेशन नहीं है। ढांकता हुआ। एथिल अल्कोहल, बेंजीन, कार्बन डाइसल्फ़ाइड CS2 में घुलनशील। सफेद फास्फोरस को हवा की अनुपस्थिति में 250-300 डिग्री सेल्सियस पर गर्म करने से लाल फास्फोरस प्राप्त होता है। सोडियम, आयोडीन और सेलेनियम और यूवी किरणों की अशुद्धियाँ एक संशोधन से दूसरे संशोधन में संक्रमण को तेज करती हैं। लाल फास्फोरस अनाकार होता है, जिसका रंग लाल रंग से लेकर गहरा भूरा और बैंगनी होता है। विभिन्न गुणों के साथ कई क्रिस्टलीय रूप हैं। क्रिस्टलीय लाल फास्फोरस (गिटोर्फ का फास्फोरस) पिघला हुआ सीसा में 600 डिग्री सेल्सियस पर संतृप्त लाल फास्फोरस के घोल को ठंडा करके प्राप्त किया जाता है। इसमें एक मोनोक्लिनिक जाली है। लाल फास्फोरस का घनत्व 2.0-2.4 किग्रा/डीएम3 है। ढांकता हुआ। गर्म होने पर, लाल फास्फोरस P4 अणुओं के रूप में वाष्पित हो जाता है, जिसके संघनन से सफेद फास्फोरस का निर्माण होता है। जब सफेद फास्फोरस को 1.2 GPa के दबाव में 200-220 ° C तक गर्म किया जाता है, तो क्रिस्टलीय काला फास्फोरस बनता है। जाली परमाणुओं की पिरामिड व्यवस्था के साथ रेशेदार परतों से बनी होती है। ब्लैक फॉस्फोरस की सबसे स्थिर किस्म में ऑर्थोरोम्बिक जाली होती है। काले फास्फोरस का घनत्व 2.702 kg/dm3 है। बाह्य रूप से ग्रेफाइट के समान; अर्धचालक, प्रतिचुंबकीय। 560-580°C तक गर्म करने पर यह लाल फास्फोरस में बदल जाता है। काला फास्फोरस निष्क्रिय है, शायद ही प्रज्वलित होता है। सफेद फास्फोरस सबसे अधिक सक्रिय है। यह हवा में ऑक्सीकरण करता है।
जब फास्फोरस को अधिक ऑक्सीजन में जलाया जाता है, तो P2O5 प्राप्त होता है, जो P4O10 डिमर और P8O20 टेट्रामर बनाता है। ऑक्सीजन की कमी से P2O3 प्राप्त होता है। ऑक्सीकरण के दौरान निकलने वाली गर्मी के कारण हवा में स्वयं प्रज्वलित होता है।
लाल फास्फोरस हवा में धीरे-धीरे ऑक्सीकरण करता है और अनायास नहीं जलता है। काला फास्फोरस हवा में ऑक्सीकृत नहीं होता है। सफेद फास्फोरस का उपयोग फॉस्फोरिक एसिड H3PO4 (खाद्य फॉस्फेट और सिंथेटिक डिटर्जेंट प्राप्त करने के लिए) के निर्माण में किया जाता है। इसका उपयोग आग लगाने वाले और धुएं के गोले, बम बनाने में किया जाता है। लाल फास्फोरस का उपयोग निर्माण में किया जाता है खनिज उर्वरक, मैच उत्पादन। फॉस्फोरस का उपयोग अलौह धातु मिश्र धातुओं के उत्पादन में एक डीऑक्सीडाइज़र के रूप में और एक मिश्र धातु के रूप में किया जाता है। इसका उपयोग अर्धचालक फॉस्फाइड के उत्पादन में, नरम चुंबकीय मिश्र धातुओं के उत्पादन में किया जाता है। फास्फोरस यौगिक दवाओं के उत्पादन के लिए प्रारंभिक सामग्री के रूप में काम करते हैं। फॉस्फोरस जीवित कोशिकाओं में ऑर्थो- और पाइरोफॉस्फोरिक एसिड के रूप में मौजूद होता है; यह न्यूक्लियोटाइड्स, न्यूक्लिक एसिड, फॉस्फोप्रोटीन, फॉस्फोलिपिड्स, कोएंजाइम और एंजाइम का हिस्सा है। मानव हड्डियों में हाइड्रॉक्सिलैपाटाइट 3Ca3(PO4)3·CaF2 होता है। दाँत तामचीनी की संरचना में फ्लोरापेटाइट शामिल है। मनुष्यों और जानवरों में फास्फोरस यौगिकों के परिवर्तन में मुख्य भूमिका यकृत द्वारा निभाई जाती है। फास्फोरस यौगिकों के आदान-प्रदान को हार्मोन और विटामिन डी द्वारा नियंत्रित किया जाता है। फास्फोरस की दैनिक मानव आवश्यकता 1-2 ग्राम है। फास्फोरस की कमी के साथ, शरीर में विभिन्न हड्डियों के रोग विकसित होते हैं। फास्फोरस यौगिक जहरीले होते हैं। घातक खुराकसफेद फास्फोरस - 50-150 मिलीग्राम। सफेद फास्फोरस त्वचा पर लगने से गंभीर जलन होती है। रासायनिक युद्ध एजेंट सरीन, सोमन और टैबून फास्फोरस यौगिक हैं। तीव्र फास्फोरस विषाक्तता मुंह और पेट में जलन, सिरदर्द, कमजोरी और उल्टी से प्रकट होती है। 2-3 दिनों के बाद, पीलिया विकसित होता है। जीर्ण रूपों को कैल्शियम चयापचय के उल्लंघन, हृदय और तंत्रिका तंत्र को नुकसान की विशेषता है। तीव्र विषाक्तता के लिए प्राथमिक चिकित्सा - गैस्ट्रिक पानी से धोना, जुलाब, सफाई एनीमा, अंतःशिरा ग्लूकोज समाधान। त्वचा में जलन के मामले में, प्रभावित क्षेत्रों को समाधान के साथ इलाज करें नीला विट्रियलया सोडा। हवा में फॉस्फोरस वाष्प का MPC 0.03 mg/m3 है। लाल फास्फोरस की धूल फेफड़ों में जाकर निमोनिया का कारण बनती है।
प्रयुक्त पुस्तकें
1. बेनेश पी।, पम्पर वी।, स्वोबोडोवा एम।, मंसूरोव जी। एन। रसायन विज्ञान में 111 प्रश्न।
एक तत्व की खोज जिसे आवर्त सारणी में शामिल किया जाएगा, विभिन्न देशों के वैज्ञानिकों के लिए अंतिम सपना है जो विश्व विज्ञान में एक बड़ा योगदान देना चाहते हैं, और साथ ही साथ अपने नाम को कायम रखना चाहते हैं। और, ऐसा लगता है, दूसरे दिन, आवर्त सारणी में एक नए तत्व में प्रवेश करने वाला एक शोधकर्ता अधिक हो गया है।
नए तत्व 112 को जर्मनी के डार्मस्टाट में भारी आयन अनुसंधान केंद्र में संश्लेषित किया गया था। एक नए तत्व की खोज पर काम का नेतृत्व करने वाले प्रोफेसर सिगर्ड हॉफमैन को पहले ही सूचना मिल चुकी है कि उनकी खोज को आवर्त सारणी में शामिल किया गया था। "नया तत्व हाइड्रोजन से लगभग 277 गुना भारी है, जो इसे तालिका में मौजूदा तत्वों में सबसे भारी बनाता है," श्री हॉफमैन कहते हैं। "हमारी खोज भी विशेष रूप से महत्वपूर्ण है क्योंकि पिछले तीस वर्षों में, तालिका में केवल छह नए तत्व शामिल किए गए हैं।"
तत्व के चयन पर काम दस साल से अधिक समय से चल रहा है। इसलिए, उनका पहला प्रायोगिक परमाणु 1996 में एक भारी कण त्वरक में बनाया गया था, लेकिन वह लंबे समय तक मौजूद नहीं रह सका विवो, जिसने वैज्ञानिकों को इसके गुणों की पहचान करने से रोका। 2002 में ही दूसरा परमाणु बनाया गया था। तत्व जस्ता और सीसा आयनों को विद्युत रूप से चार्ज करके और उन्हें 120-मीटर कण त्वरक में तेज करके प्राप्त किया गया था।
"जस्ता और सीसा के नाभिक 112 की परमाणु संख्या के साथ एक मौलिक रूप से नए तत्व में एक परमाणु प्रतिक्रिया की प्रक्रिया में संयुक्त होते हैं। वास्तव में, नया तत्व जस्ता और सीसा का योग है, जिनमें से पहला 30 वां परमाणु है संख्या, और दूसरा - 82 वां। इसके परमाणु के अंदर न्यूट्रॉन का एक समूह है और 112 इलेक्ट्रॉन अपनी कक्षाओं में घूम रहे हैं, ”सिगर्ड हॉफमैन कहते हैं।
सात वर्षों से, वैज्ञानिक एक नए तत्व के गुणों का वर्णन कर रहे हैं और इसकी विशेषताओं का अध्ययन कर रहे हैं, और इसके परिणामस्वरूप, इस वर्ष के जून में, इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री (IUPAC) ने तत्वों की प्रणाली को एक के साथ पूरक करने का निर्णय लिया। नया अतिभारी पदार्थ। अब नए तत्व के नाम पर फैसला होना बाकी है। जर्मन वैज्ञानिकों को इस महत्वपूर्ण मुद्दे को तीन सप्ताह के भीतर हल करना होगा, और छह महीने बाद तत्व को एक आधिकारिक नाम प्राप्त होगा, जो आवर्त सारणी में इसका नया औपचारिक क्लासिफायरियर बन जाएगा।
“नए तत्व का नाम कॉलेजियम द्वारा निर्धारित किया जाएगा। इसकी खोज में जर्मनी, फिनलैंड, स्लोवाकिया और रूस के वैज्ञानिक शामिल थे। परियोजना में कुल मिलाकर 21 लोग शामिल थे, इसलिए इसकी संभावना नहीं है कि तत्व का नाम इसके खोजकर्ता के नाम पर रखा जा सके," श्री हॉफमैन कहते हैं।
इस बीच, जापानी भौतिक विज्ञानी व्यावहारिक रूप से अपने यूरोपीय सहयोगियों से पीछे नहीं हैं, जो आवधिक प्रणाली में एक नए तत्व को अंकित करने की उम्मीद नहीं छोड़ते हैं। सैतामा प्रीफेक्चुरल यूनिवर्सिटी के प्रोफेसर कोसुके मोरिता के नेतृत्व में शोधकर्ताओं के एक समूह ने बेहद कम जीवन काल के साथ एक नए रासायनिक तत्व की खोज की है। वैज्ञानिकों के अनुसार, प्रोटॉन संख्या 113 सहित एक नए प्रकार के केवल कुछ परमाणु नाभिक पृथक किए गए थे। अस्सी दिनों के लिए, जापानी एक त्वरक में जस्ता (प्रोटॉन 30) और बिस्मथ (प्रोटॉन 83) के नाभिक से टकराए, जिसके परिणामस्वरूप जिससे एक नए रासायनिक तत्व का जन्म हुआ, जिसका जीवनकाल केवल 0.0003 सेकेंड तक रहा। हालांकि, यह समय भी अति-संवेदनशील कैमरों के लिए नए तत्व की विशेषताओं को पकड़ने के लिए पर्याप्त था - यह लगातार अल्फा कणों का उत्सर्जन करता है और हल्के नाभिक में विभाजित होता है। इस तत्व की द्रव्यमान संख्या 278 है, इसके नाभिक में 113 प्रोटॉन और 165 न्यूट्रॉन हैं। जश्न मनाने के लिए, वैज्ञानिक जापान में बनाए गए पहले कृत्रिम तत्व के लिए "मूल" नाम "जापान" के साथ भी आए।
इज़राइल, जर्मनी, स्वीडन और संयुक्त राज्य अमेरिका की एक अंतरराष्ट्रीय शोध टीम द्वारा एक और "जीवित" तत्व की खोज की गई। जेरूसलम के हिब्रू विश्वविद्यालय के अम्नोन मारिनोव के नेतृत्व में वैज्ञानिकों ने परमाणु संख्या 122 और 292 के सापेक्ष परमाणु द्रव्यमान के साथ एक अतिभारी तत्व का प्रमाण पाया है। थोरियम युक्त खनिज के प्रसंस्करण के बाद से, एकेटोरियम नामक तत्व शुद्ध प्राकृतिक थोरियम में पाया गया था। मोनाजाइट बहुत मुश्किल होगा। अध्ययन में आगमनात्मक युग्मित प्लाज्मा के साथ मास स्पेक्ट्रोमेट्री की विधि का उपयोग किया गया। नमूनों को परमाणुओं में विघटित किया गया और उनमें से प्रत्येक की जांच की गई। 230 और 232 के परमाणु द्रव्यमान वाले दो समस्थानिकों के रूप में थोरियम के अलावा, विभिन्न ऑक्साइड और हाइड्राइड, 122 के करीब परमाणु संख्या वाला एक पूर्व अज्ञात तत्व नमूनों में पाया गया था। वैज्ञानिकों के अनुसार, इसका आधा जीवन हो सकता है 100 मिलियन से अधिक वर्ष।
हालाँकि, आवर्त सारणी में शामिल सबसे भारी तत्व की खोज दुबना के वैज्ञानिकों ने शिक्षाविद यूरी ओगनेसियन के नेतृत्व में की थी। लिवरमोर के सहयोगियों के साथ, रूसी भौतिकविदों ने प्रयोगों की पहली सफल श्रृंखला आयोजित की, जिसके दौरान तत्व 118 का जन्म और इसका क्षय दर्ज किया गया। यह सब एक सेकंड के हज़ारवें हिस्से में। इसके अलावा, डबनिंस्क भौतिकविदों ने अपेक्षाकृत बहुत पहले तथाकथित "स्थिरता के द्वीपों" के बारे में एक परिकल्पना सामने रखी थी, जिसमें सुपरहेवी तत्वों के अस्तित्व का सुझाव दिया गया था, जिनमें से आधा जीवन एक सेकंड का अंश नहीं हो सकता है, लेकिन कई मिनटों से हो सकता है। कई वर्षों तक, और उनके पास नए, असामान्य रासायनिक गुण हो सकते हैं।
"हम अपनी भौतिक दुनिया में सभी पदार्थों के आधार के रूप में परमाणु नाभिक की संरचना की आधुनिक समझ के बारे में बात कर रहे हैं," यूरी अबोव, सैद्धांतिक और प्रायोगिक भौतिकी संस्थान के वरिष्ठ शोधकर्ता, रूसी विज्ञान अकादमी के संबंधित सदस्य कहते हैं। . "यह सुझाव दिया गया है कि इन अतिभारी तत्वों में अप्रत्याशित गुण हो सकते हैं जिनका आकाशगंगा निर्माण के प्रारंभिक चरण में परमाणुओं के निर्माण पर निर्णायक प्रभाव पड़ा, जब परमाणु नाभिक अति उच्च तापमान पर टकराते थे।" इस प्रकार, 21 वीं सदी में खोजे गए अतिभारी तत्व एक बिल्कुल नया मामला है, जिसका अध्ययन और व्यावहारिक उपयोग आधुनिक विज्ञान की सीमाओं का काफी विस्तार करेगा।
बोरिस ज़ुइकोव - रेडियोकेमिस्ट, डॉ। रसायन विज्ञान, सिर। रूसी विज्ञान अकादमी के परमाणु अनुसंधान संस्थान के रेडियोआइसोटोप परिसर की प्रयोगशाला, जो पहले JINR (दुबना) की परमाणु प्रतिक्रियाओं की प्रयोगशाला में कई वर्षों तक काम करती थी, नए तत्वों के गुणों के अध्ययन में लगी हुई थी।
मेंडलीफ की आवर्त सारणी में नए तत्वों की खोज ने हमेशा आम जनता की रुचि जगाई है। बात इन खोजों के वैज्ञानिक महत्व की नहीं है, बल्कि यह तथ्य है कि स्कूल में हर कोई आवधिक कानून के माध्यम से चला गया, और कुछ को तत्वों को दर्शाने वाले प्रतीकों को भी याद है। यह समझ में आता है, परिचित है। लेकिन अब इन खोजों के पीछे परमाणु भौतिकी और रेडियोकैमिस्ट्री में जटिल शोध हैं, जिनके बारे में बहुत से लोगों को पता नहीं है।
वर्तमान में नए तत्व केवल भारी आयन त्वरक पर ही प्राप्त होते हैं। (पहले, वे स्थलीय खनिजों, परमाणु रिएक्टरों और परमाणु विस्फोटों के उत्पादों में पाए जाते थे।) भारी तत्वों से साइक्लोट्रॉन या रैखिक त्वरक बमबारी लक्ष्य में भारी आयन, और एक या एक से अधिक न्यूट्रॉन के उत्सर्जन के साथ संलयन प्रतिक्रिया के परिणामस्वरूप, सीरियल नंबर के साथ एक नया तत्व संश्लेषित होता है ( परमाणु प्रभार) - घटना आयन और लक्ष्य नाभिक के नाभिक के आरोपों का योग। परिणामी नाभिक तब रेडियोधर्मी क्षय से गुजरते हैं। सबसे स्थिर समस्थानिकों के संश्लेषण के लिए, नाभिक के ऐसे संयोजनों को चुना जाता है जिनमें अधिक से अधिक न्यूट्रॉन होते हैं और यौगिक नाभिक में कम उत्तेजना ऊर्जा होती है। प्राप्त भारी तत्वों की उपज अत्यंत कम है - एकल परमाणु या दसियों परमाणु, कभी-कभी त्वरक पर विकिरण के महीनों के दौरान। आधा जीवन सेकंड है, और कभी-कभी मिलीसेकंड के अंश। परमाणु प्रतिक्रियाओं के परिणामी उत्पादों के पूरे मिश्रण से नए तत्वों के नाभिक को अलग करना और परिणामी उत्पादों की सही पहचान करना काफी मुश्किल है। इसके लिए, विशेष प्रतिष्ठान बनाए जाते हैं, जिसके परिणामस्वरूप, अल्फा कणों के उत्सर्जन और हल्के तत्वों के समस्थानिकों के निर्माण के साथ क्षय की एक श्रृंखला दर्ज की जाती है, कभी-कभी श्रृंखला नाभिक के सहज विखंडन के साथ समाप्त होती है।
हमारे देश में, 1950 के दशक से, एकेड के मार्गदर्शन में दुबना में भारी आयन त्वरक पर नए तत्वों के संश्लेषण पर काम किया जाता रहा है। जी.एन. फ्लेरोव (1913-1990) - इस दिशा के संस्थापक। अब इन कार्यों को एकेड की वैज्ञानिक देखरेख में किया जाता है। यू। टीएस ओगनेस्यान। दुनिया में केवल कुछ ही त्वरक और प्रतिष्ठान हैं जहां ट्रांसएक्टिनोइड तत्व (यानी, 103 से अधिक के परमाणु चार्ज जेड वाले तत्व) प्राप्त किए जा सकते हैं।
IUPAC (इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री) के नवीनतम निर्णय ने एक साथ चार तत्वों की खोज को मान्यता दी - क्रमांकित 113, 115, 117 और 118 - ने रूसी जनता का ध्यान भी आकर्षित किया क्योंकि उनमें से तीन में प्राथमिकता - 115, 117 और 118 - रूसी-अमेरिकी सहयोग के लिए मान्यता प्राप्त है, जिसमें परमाणु अनुसंधान के लिए संयुक्त संस्थान (दुबना) (FLAR JINR), लॉरेंस लिवरमोर नेशनल लेबोरेटरी (LLNL), ओक रिज नेशनल लेबोरेटरी (ORNL) की न्यूक्लियर रिएक्शन की फ्लेरोव प्रयोगशाला शामिल है। ) और वेंडरबिल्ट विश्वविद्यालय। जापानी त्वरक अनुसंधान केंद्र RIKEN के एक समूह को तत्व 113 की खोज में प्राथमिकता दी जाती है।
प्राथमिकता निर्धारित करना कोई आसान काम नहीं है, क्योंकि किसी खोज की पहली रिपोर्ट में अशुद्धि कुछ हद तक अपरिहार्य है। सवाल यह है कि कौन सी अशुद्धियाँ महत्वपूर्ण हैं, और किन लोगों को स्वीकार किया जा सकता है, और किस हद तक लेखकों के निष्कर्ष उचित हैं। IUPAC का निर्णय ज्वाइंट वर्किंग पार्टी (JWP) की रिपोर्ट और पहले से विकसित शुरुआती मानदंड पर आधारित था। वर्तमान प्रथा के अनुसार, लेखकों को नए तत्वों के लिए नाम प्रस्तावित करने का अधिकार दिया गया है।
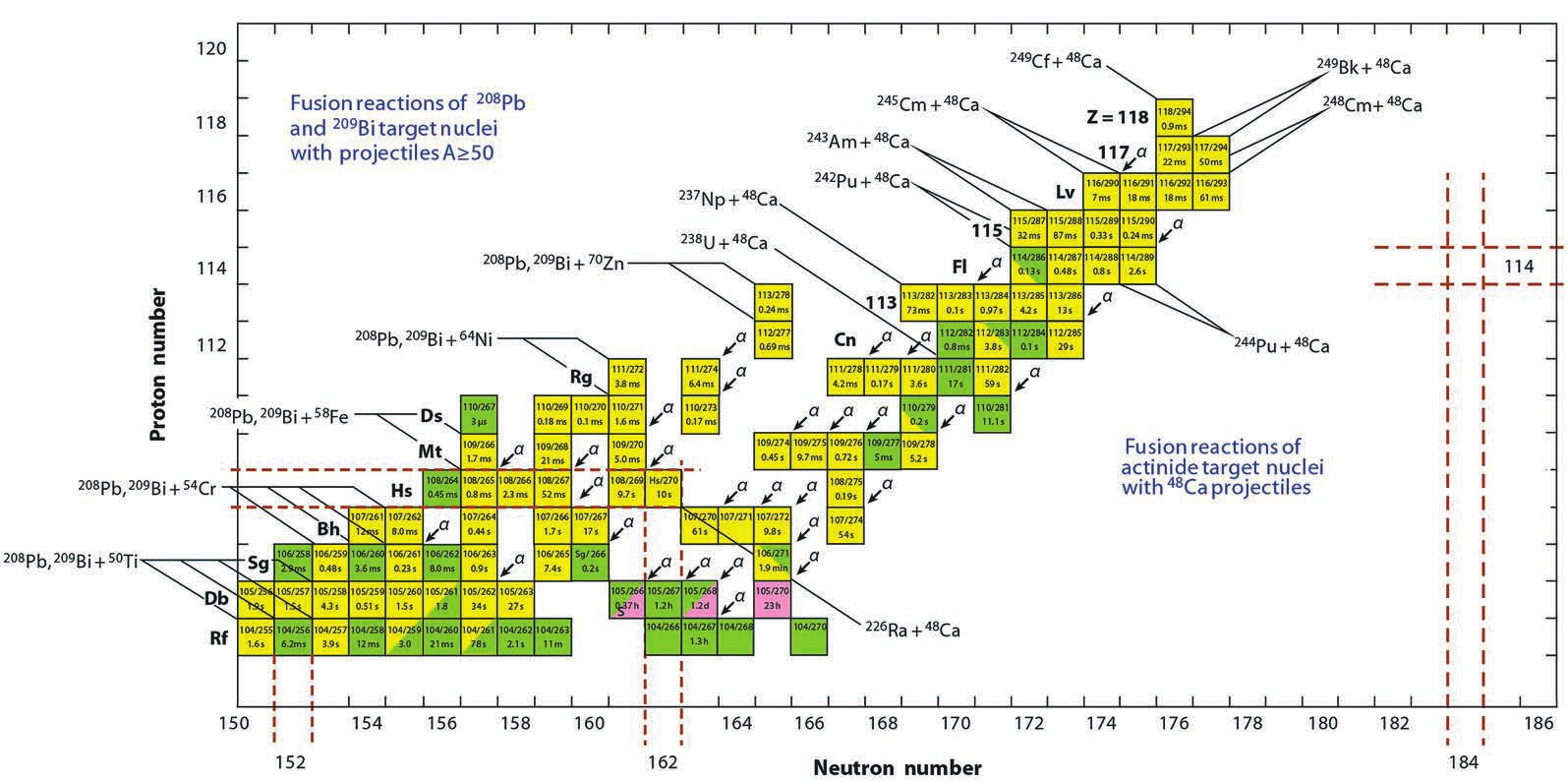
प्राथमिकता पत्र FLAR JINR और RIKEN द्वारा लगभग 2004 में लगभग एक साथ प्रकाशित किए गए थे, दुबना के समूह ने कुछ हद तक पहले भी पेपर प्रकाशित किया था। जापान में नए नाभिक के संश्लेषण के लिए, एक "ठंडा" संलयन प्रतिक्रिया का उपयोग किया गया था, एक आइसोटोप 278 113 (आजीवन - मिलीसेकंड और मिलीसेकंड के दसवें) के गठन के साथ, एक जस्ता आइसोटोप के साथ एक बिस्मथ लक्ष्य 70 Zn + 209 Bi पर बमबारी।
दुबना में, कैल्शियम और अमेरिकियम 48 Ca + 243 Am के भारी आइसोटोप के आयनों की एक अधिक अनुकूल (उपज और अर्ध-जीवन के संदर्भ में) परमाणु प्रतिक्रिया का उपयोग किया गया था, जिससे आइसोटोप 288 115 और 287 115 का निर्माण होता है। ये रेडियोन्यूक्लाइड, अल्फा कणों का उत्सर्जन करते हैं, क्रमशः 284 113 और 283 113 (आजीवन - सैकड़ों मिलीसेकंड) में क्षय होते हैं, और फिर एक श्रृंखला में तत्व 105 (डबनियम, डीबी) के लंबे समय तक रहने वाले आइसोटोप में। 268 डीबी को रासायनिक रूप से अलग किया गया और फिर सहज विखंडन दर्ज किया गया।
लेकिन इन क्षय श्रृंखलाओं में मध्यवर्ती न्यूक्लाइड उस समय ज्ञात नहीं थे, और उनकी स्वतंत्र भौतिक पहचान नहीं की गई थी। और जेआईएनआर एफएलएनआर में किए गए आयन एक्सचेंज के आधार पर डीबी के रासायनिक अलगाव और पहचान को संयुक्त कार्य समूह द्वारा गैर-चयनात्मक और अनिर्णायक माना गया। इसके अलावा, गैस क्रोमैटोग्राफी द्वारा तत्व 113 के रासायनिक गुणों का अध्ययन करने के प्रयासों को ध्यान में नहीं रखा गया था, हालांकि इस पद्धति का पहले अन्य ट्रांसएक्टिनोइड तत्वों के रसायन विज्ञान का अध्ययन करने के लिए सफलतापूर्वक उपयोग किया गया था। नतीजतन, यह निष्कर्ष निकाला गया कि इस मामले में दुबना का आवेदन तत्वों को खोलने के मानदंडों को पूरा नहीं करता है।
इसी समय, जापान में संश्लेषित आइसोटोप 278 113 के सभी मध्यवर्ती क्षय उत्पादों (8 वर्षों के काम में कुल 3 घटनाएं) की पुष्टि की गई, जिसमें चीन में नए लैंज़ो हेवी आयन रिसर्च सेंटर में विशेष प्रयोग शामिल हैं। इस प्रकार, तत्व 113 की खोज में प्राथमिकता जापानी समूह को दी गई।
मद 115डबना में संश्लेषित किया गया था, और उस क्षेत्र के सम्मान में जहां यह अंतरराष्ट्रीय केंद्र स्थित है, लेखकों ने मोस्कोवियम (मॉस्कोवियम, मैक) नाम का प्रस्ताव दिया। तत्व को फिर से परमाणु प्रतिक्रिया 48 Ca + 243 Am में 287 115 और 288 115 (जीवनकाल क्रमशः दसियों और सैकड़ों मिलीसेकंड) के गठन के साथ प्राप्त किया गया था। बाद में इस तत्व के 289 115 तथा अन्य समस्थानिक प्राप्त हुए। रासायनिक प्रयोगों के पहले चक्र के विपरीत, जिसे डबना समूह ने स्वतंत्र रूप से किया, बाद में, 2007 में, क्षय उत्पाद का रासायनिक अलगाव - 268 डीबी पहले से ही लिवरमोर के अमेरिकी विशेषज्ञों की भागीदारी के साथ किया गया था, और इससे संबंधित तत्व - 115-वें तत्व का क्षय उत्पाद - आवधिक प्रणाली के V समूह को।
इसके अलावा, 2013 में, जर्मन सेंटर फॉर हैवी आयन रिसर्च इन डार्मस्टाड (जीएसआई) के एक सहयोग ने परमाणु प्रतिक्रिया 48 सीए + 243 एएम में तत्व 115 के आइसोटोप प्राप्त करने पर डबिन परिणामों को दोहराने में सफलता प्राप्त की। इस प्रकार, तत्व 115 की खोज में प्राथमिकता रूसी-अमेरिकी समूह को दी गई थी।
तत्व 117अमेरिकी राज्य टेनेसी के सम्मान में टेनेसिन (टी) नाम देने का प्रस्ताव है, जहां ओक रिज नेशनल लेबोरेटरी स्थित है। नाम में अंत एस्टैटिन और हलोजन समूह के अन्य तत्वों के अनुरूप है (on अंग्रेजी भाषा) इस तत्व को डबना में भी संश्लेषित किया गया था, परमाणु प्रतिक्रिया 48 सीए + 249 बीके। ओक रिज के अमेरिकी सहयोगियों की भूमिका मुख्य रूप से एक अद्वितीय बर्केलियम -249 लक्ष्य बनाना था, जिसे ओआरएनएल में उच्च प्रवाह रिएक्टर में बनाया गया था। 2010-2013 में, 293 117 और 294 117 की केवल 13 क्षय श्रृंखला पंजीकृत की गई थी, और 289 115 क्षय उत्पाद की विशेषताएं (आजीवन और अल्फा क्षय ऊर्जा) इस रेडियोन्यूक्लाइड के लिए एक अन्य परमाणु प्रतिक्रिया 48 Ca + 243 में पहले प्राप्त आंकड़ों के अनुरूप थीं। पूर्वाह्न। इस कारण से, इस तत्व की खोज के लिए आवेदन स्थापित मानदंडों को पूरा करने के लिए पाया गया था।
तत्व 118लेखकों ने ओगनेसन (ओगनेसन, ओग) नाम का प्रस्ताव दिया। यह रेडॉन और अन्य अक्रिय गैसों का एक एनालॉग होना चाहिए, और इसकी खोज आवर्त सारणी की सातवीं अवधि को पूरा करती है। इस तत्व का नाम यूरी सोलाकोविच ओगनेस्यान के सम्मान में रखा जाना प्रस्तावित है, जो ट्रांसएक्टिनॉइड तत्वों के अध्ययन और सुपरहेवी न्यूक्लियर की खोज में महत्वपूर्ण परमाणु भौतिकी उपलब्धियों और "परमाणु स्थिरता के द्वीप" के अध्ययन में उनके अग्रणी योगदान के लिए है। इतिहास में केवल एक और उदाहरण था जब एक सक्रिय वैज्ञानिक को एक तत्व का नाम सौंपा गया था। एलीमेंट 106 का नाम 1997 सीबोर्गियम (एसजी) में ग्लेन सीबॉर्ग (1912-1999), पुरस्कार विजेता के सम्मान में रखा गया था। नोबेल पुरुस्कारप्लूटोनियम और कई ट्रांसप्लूटोनियम तत्वों की खोज के लेखक।
2002-2012 में, दुबना में, जब 249 सीएफ लक्ष्य 48 सीए आयनों के साथ विकिरणित किया गया था, 294 118 (जीवनकाल लगभग 1 मिलीसेकंड) के गठन की कई घटनाओं का पता चला था, साथ में 290 एलवी (लिवरमोरियम) के क्रमिक क्षय के साथ। , 286 Fl (फ्लेरोवियम) और 282 Cn (कॉपरनिकियम)। इन समस्थानिकों Fl और Cn के अल्फा कणों के जीवनकाल और ऊर्जा की पुष्टि बर्कले साइक्लोट्रॉन में अमेरिकी सहयोग द्वारा की गई थी, इसलिए संयुक्त कार्य समूह ने सिफारिश की कि खोज को मान्यता दी जाए।
यह ध्यान दिया जाना चाहिए कि सभी नए प्रस्तावित तत्वों के नाम और प्रतीकों को अभी तक IUPAC द्वारा अनुमोदित नहीं किया गया है।
इन नए तत्वों की खोज का क्या महत्व है?
प्रश्न "यह कितनी रोटी और कोयला दे सकता है?" बिल्कुल गलत। मौलिक विज्ञान की एक निश्चित शाखा के विकास के लाभों की भविष्यवाणी करना अक्सर असंभव होता है, और इस तरह के तर्कों को इसके विकास में बाधा नहीं बननी चाहिए। से आय और राजनीतिक लाभ को पूर्व-चित्रित करने का प्रयास वैज्ञानिक खोजहास्यास्पद। प्रतिष्ठा के विचार भी किसी तरह दिशा के विकास को सीमित नहीं करना चाहिए, क्योंकि इसका सही अर्थ बहुत बाद में सामने आ सकता है। इसके विपरीत, अत्यधिक प्रचारित उपलब्धियों का कोई महत्वपूर्ण अनुवर्तन नहीं हो सकता है। सामान्य तौर पर, विज्ञान को अपने तर्क से निर्देशित होना चाहिए, न कि उन लोगों के तर्क से जो इससे दूर हैं। समाज को वैज्ञानिकों पर भरोसा करना चाहिए, और "सार्वजनिक खर्च पर अपनी जिज्ञासा को संतुष्ट करना" मानव गतिविधि के इस क्षेत्र में सामान्य स्थिति है। और यह वैज्ञानिक, योग्य विशेषज्ञ हैं जिन्हें यह निर्धारित करना चाहिए कि किस पर पैसा खर्च किया जाना चाहिए, और क्या इंतजार कर सकता है या आम तौर पर अप्रमाणिक है।
एक और सवाल यह है कि नए तत्वों की खोज पर इस परिणाम का वैज्ञानिक महत्व क्या हो सकता है। यह नाभिक की संरचना और के बारे में हमारे विचारों में क्या परिवर्तन करता है? रासायनिक गुणआह तत्व बिल्कुल?
भौतिक दृष्टिकोण से, इन परिणामों का परमाणु संरचना और परमाणु संपर्क की बेहतर समझ के लिए निहितार्थ हो सकते हैं। 1960 के दशक से, परमाणु आवेशों Z = 114 और 126 के क्षेत्र में स्थिरता के तथाकथित द्वीपों के अस्तित्व के प्रश्न पर नाभिक की खोल संरचना की अभिव्यक्ति के रूप में जोरदार चर्चा की गई है। इसलिए, पहले ट्रांसएक्टिनॉइड तत्वों को प्राप्त करना, जिसमें नाभिक की संरचना के पुराने "ड्रॉप" मॉडल की भविष्यवाणी की तुलना में बहुत लंबा आधा जीवन था, वास्तव में मौलिक रूप से महत्वपूर्ण था। अब किसी को शेल मॉडल पर शक नहीं है। नए तत्वों और नए समस्थानिकों पर प्राप्त परिणाम नाभिक और परमाणु प्रतिक्रियाओं के मौजूदा मॉडल को परिष्कृत करना संभव बनाते हैं। हालांकि मौलिक रूप से नई घटनाओं की उम्मीद नहीं की जाती है, लेकिन नए डेटा का एक सेट हमेशा उपयोगी होता है। यह स्पष्ट है कि मौजूदा तरीकों से स्थिरता के द्वीप के शीर्ष तक नहीं पहुंचा जा सकता है: परमाणु प्रतिक्रियाओं में ऐसे कोई संयोजन नहीं हैं - परिणामी आइसोटोप में पर्याप्त न्यूट्रॉन नहीं हैं। पहले, कई वर्षों तक, प्राकृतिक नमूनों में एसएचई का पता लगाने के प्रयास किए गए थे जो इतने लंबे समय तक जीवित रहेंगे कि वे सौर मंडल के गठन के समय से बने रह सकें। लेकिन ये प्रयास असफल रहे। एक बार दावा किए गए परिणामों को या तो प्रयोगात्मक या सैद्धांतिक पुष्टि नहीं मिली है।
रासायनिक दृष्टि से स्थिति कुछ भिन्न है। यहां हम वास्तव में मौलिक रूप से नई घटनाओं की उम्मीद कर सकते हैं। बिंदु तथाकथित "सापेक्ष प्रभाव" है। एक बड़े परमाणु चार्ज वाले परमाणुओं में, इलेक्ट्रॉन सापेक्ष गति प्राप्त करते हैं, और परमाणुओं का वर्णन करने के लिए इस्तेमाल किया जाने वाला सामान्य श्रोडिंगर समीकरण अब काम नहीं करता है। विशेष रूप से, पी-इलेक्ट्रॉनों के प्रसिद्ध "डंबल्स" सातवीं-अवधि में परिवर्तन से गुजरते हैं, और उनमें से एक गेंद में बदल जाता है। नतीजतन, परमाणुओं की इलेक्ट्रॉनिक संरचना बदल जाती है। नए तत्वों में आवर्त सारणी से निकाले गए रासायनिक गुणों और असामान्य रासायनिक गुणों की उपस्थिति से महत्वपूर्ण विचलन हो सकता है।
"सापेक्ष प्रभाव" के बारे में बहुत सी अटकलें हैं, जाहिरा तौर पर इस मुद्दे में रुचि बढ़ाने के उद्देश्य से। उदाहरण के लिए, यह सुझाव दिया गया है कि तत्व 104 रदरफोर्डियम (आरएफ), टाइटेनियम, ज़िरकोनियम और हेफ़नियम का एक औपचारिक एनालॉग, सीसा के करीब रासायनिक गुणों के साथ एक पी-तत्व बन सकता है। या यह कहा गया था कि तत्व 114 फ्लोरोवियम (Fl) - सीसा का एक एनालॉग - एक अक्रिय गैस बन सकता है। वास्तव में, सावधानीपूर्वक विचार करने से पता चलता है कि यद्यपि Rf परमाणु में बाहरी इलेक्ट्रॉन शेल (ds 2 p) का एक असामान्य विन्यास है, इसके रासायनिक गुणों के संदर्भ में यह एक विशिष्ट d-तत्व है, जो हेफ़नियम के अनुरूप है। और Fl, बढ़ी हुई अस्थिरता (किसी भी एक्सट्रपलेशन से निम्नानुसार) के साथ, संघनित अवस्था में एक विशिष्ट धातु बनी हुई है। सामान्य तौर पर, आवधिक प्रणाली के अनुसार एक्सट्रपलेशन से किसी भी विचलन को "सापेक्ष प्रभाव" के लिए जिम्मेदार ठहराना बिल्कुल गलत है: यह पूरी तरह से अलग कारणों से हो सकता है, उदाहरण के लिए, इंटरकॉन्फिगरेशनल इंटरैक्शन।
एक तरह से या किसी अन्य, सापेक्षतावादी प्रभावों का अध्ययन लंबे समय से ज्ञात और व्यापक रूप से उपयोग किए जाने वाले तत्वों के रासायनिक गुणों को बेहतर ढंग से समझना संभव बनाता है। यह इस बात की बेहतर समझ की भी अनुमति देता है कि परमाणुओं और अणुओं की इलेक्ट्रॉनिक संरचना, जिसकी गणना की जा सकती है, उनके विशिष्ट रासायनिक गुणों को कैसे निर्धारित करती है। यह अभी भी पूरी तरह से हल किए गए मुद्दे से बहुत दूर है। आवर्त सारणी में आगे की प्रगति से तत्वों का एक बिल्कुल नया समूह बन सकता है - जी-तत्व (तत्व 121 से शुरू) दिलचस्प गुणों के साथ। ये सभी प्रश्न अभी भी विस्तृत अध्ययन की प्रतीक्षा कर रहे हैं।
हालांकि, यह ध्यान दिया जाना चाहिए कि हाल की खोजों में, नए तत्वों के रासायनिक गुणों का अध्ययन बिल्कुल भी प्रकट नहीं होता है (केवल तत्व 115, तत्व 105, डीबी का क्षय उत्पाद, क्षय श्रृंखला के अंत की पुष्टि करने के लिए रासायनिक रूप से पृथक किया गया था) . लेकिन परिणामी आइसोटोप की कम उपज और कम आधे जीवन के कारण ऐसा अध्ययन करना मुश्किल था। फिर भी, यह संभव है, हालांकि रासायनिक प्रयोगों को स्थापित करने के लिए एक नए दृष्टिकोण की आवश्यकता है।
