אטומים מחוברים בקשרים קוולנטיים לא קוטביים. קוולנטי לא קוטבי (לא מתכת-לא מתכת)
קוולנטי: לא קוטבי, קוטבי, תורם-מקבל
יונית
מַתֶכֶת
מֵימָן
קשר קוולנטי
קשר קוולנטי (קשר אטומי, קשר הומיאופולארי) - קשר כימי הנוצר מחפיפה (סוציאליזציה) של זוג ענני אלקטרוני ערכיות. ענני האלקטרונים (אלקטרונים) המספקים תקשורת נקראים זוג אלקטרונים משותף.
קשר קוולנטי פשוט נוצר משני אלקטרונים ערכיים לא מזווגים, אחד
מכל אטום:
A + B → A: B
כתוצאה מסוציאליזציה, אלקטרונים יוצרים רמת אנרגיה מלאה. קשר נוצר אם האנרגיה הכוללת שלהם ברמה זו קטנה מאשר במצב ההתחלתי (וההבדל באנרגיה יהיה לא יותר מאנרגיית הקשר).
קוולנטי לא קוטבי (לא מתכת-לא מתכת)
אם האטומים היוצרים קשר קוולנטי פשוט זהים, אז גם המטענים האמיתיים של האטומים במולקולה זהים, שכן האטומים היוצרים את הקשר הם בעלי זוג אלקטרונים משותף באותה מידה. קשר כזה נקרא קשר קוולנטי לא קוטבי. לקשר כזה יש חומרים פשוטים, למשל: O2, N2, Cl2. אבל לא רק לא-מתכות מאותו סוג יכולות ליצור קשר לא קוטבי קוולנטי. קשר קוולנטי לא קוטבי יכול להיווצר גם על ידי יסודות לא מתכתיים, שהאלקטרושליליות שלהם שווה, למשל במולקולת PH3, הקשר הוא קוולנטי לא קוטבי , מכיוון שה-EO של מימן שווה ל-EO של זרחן.
קוטבי קוולנטי (EOₐ≠EOₓ)
אם האטומים שונים, אזי מידת הבעלות על זוג אלקטרונים סוציאלי נקבעת על ידי ההבדל באלקטרושליליות של האטומים. אטום בעל אלקטרושליליות גדולה יותר מושך אליו זוג אלקטרוני קשר חזק יותר, והמטען האמיתי שלו הופך שלילי. אטום עם פחות אלקטרושליליות רוכש, בהתאמה, את אותו מטען חיובי. אם נוצרת תרכובת בין שתי לא-מתכות שונות, אז תרכובת כזו נקראת קשר קוולנטי קוטבי .
תורם-מקבל
מנגנון התורם-המקבל (אחרת מנגנון התיאום) הוא שיטה ליצירת קשר כימי קוולנטי בין שני אטומים או קבוצת אטומים, המתבצעת עקב צמד האלקטרונים הבודד של האטום התורם והמסלול החופשי של התורם. אטום מקבל.
המונחים "קשר תורם-מקבל" או "קשר קואורדינציה" אינם נכונים, שכן לא מדובר בסוג של קשר כימי, אלא רק במודל תיאורטי המתאר את המוזרות של היווצרותו. התכונות של קשר כימי קוולנטי שנוצר על ידי מנגנון התורם-המקבל אינן שונות בשום צורה מתכונות הקשרים הנוצרים על ידי מנגנון ההחלפה (לדוגמה, קשרי N-Hביון אמוניום NH4+ או אג"ח O-Hביון ההידרוניום H3O+).
קטיון אנאורגני מורכב הממלא את התפקיד של מתכת חד ערכית בתרכובות. הנוסחה הכימית היא NH4+. כאשר אמוניה מומסת בתמיסות חומצה, מתרחשת התגובה הבאה:
NH3 + H+ = NH4+
^
הידרוקסוניום (אוקסוניום, הידרוניום) H3O + הוא יון מורכב, שילוב של פרוטון עם מולקולת מים.

תורמים הם בדרך כלל אטומים של חנקן, חמצן, זרחן, גופרית וכו', שיש להם זוגות אלקטרונים לא משותפים באורביטלים ערכיים קטנים. תפקידו של מקבל יכול להתבצע על ידי אטום מימן מיונן H +, כמה מתכות p (לדוגמה, אלומיניום ביצירת יון AlH4-) ובפרט, יסודות d שיש להם תאי אנרגיה לא מלאים בערכיות שכבת אלקטרונים.
מנקודת המבט של מנגנון התורם-המקבל מתוארת יצירת קשרים קוולנטיים מקומיים במולקולות ויונים מולקולריים של תרכובות מורכבות (קואורדינציה): הקשר נוצר עקב זוג האלקטרונים הבודד של הליגנד והאורביטל החופשי. של האטום המורכב. מנגנון התורם-המקבל מתאר גם את היווצרותם של תוצרי ביניים של תגובה, כגון מתחמי העברת מטען.
המודל של מנגנון התורם-המקבל קיים רק במסגרת מושג הערכיות כלוקאליזציה של צפיפות האלקטרונים במהלך יצירת קשרים קוולנטיים (שיטת ערכיות). במסגרת שיטת המסלול המולקולרי, אין צורך בייצוגים כאלה.
^
II. קשר יוני (מתכת-לא מתכת)
קשר יוני - קשר כימי חזק שנוצר בין אטומים עם הבדל גדול ( >1,7
בסולם פאולינג) של אלקטרושליליות, שבה זוג האלקטרונים המשותף עובר לחלוטין לאטום בעל אלקטרושליליות גבוהה יותר. זוהי המשיכה של יונים כגופים בעלי מטען הפוך. דוגמה לכך היא התרכובת CsF, שבה "דרגת היוניות" היא 97% הבה נבחן את שיטת היווצרות באמצעות נתרן כלוריד NaCl כדוגמה. התצורה האלקטרונית של אטומי נתרן וכלור יכולה להיות מיוצגת כ: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 3s2 3p5
כאילו זה אטומים עם רמות אנרגיה לא שלמות. ברור שכדי להשלים אותם קל יותר לאטום נתרן לוותר על אלקטרון אחד מאשר להוסיף שבעה, וקל יותר לאטום כלור להוסיף אלקטרון אחד מאשר לוותר על שבעה. בְּ אינטראקציה כימיתאטום הנתרן תורם לחלוטין אלקטרון אחד, ואטום הכלור מקבל אותו. באופן סכמטי, ניתן לכתוב זאת כך: Naº - l e -> Na +יון נתרן, קליפה יציבה של שמונה אלקטרונים 1s2 2s2 2p6 עקב רמת האנרגיה השנייה.
Clº + 1е → Cl¯- יון כלור, מעטפת יציבה בת שמונה אלקטרונים. כוחות משיכה אלקטרוסטטיים נוצרים בין ה-Na+ ו-Cl-, וכתוצאה מכך נוצרת תרכובת. קשר יוני הוא מקרה קיצוני של קיטוב של קשר קוטבי קוולנטי. נוצר בין מתכת טיפוסית ללא מתכת.
במקרה זה, האלקטרונים מהמתכת עוברים לחלוטין אל הלא-מתכת. נוצרים יונים - חלקיקים טעונים.
אם נוצר קשר כימי בין אטומים שיש להם הפרש אלקטרושליליות גדול מאוד (EO > 1.7 לפי פאולינג. טבלת ה-EO מוצגת להלן), אז צמד האלקטרונים המשותף עובר לחלוטין לאטום בעל EO גדול יותר. התוצאה של זה היא היווצרות של תרכובת של יונים בעלי מטען הפוך:
בין היונים שנוצרו יש משיכה אלקטרוסטטית, הנקראת קשר יוני. במקום זאת, נוף כזה נוח. למעשה, הקשר היוני בין אטומים בצורתו הטהורה אינו מתממש בשום מקום או כמעט בשום מקום; בדרך כלל, למעשה, הקשר הוא חלקו יוני וחלקו קוולנטי. יחד עם זאת, החיבור של יונים מולקולריים מורכבים יכול להיחשב לעתים קרובות יוני בלבד. ההבדלים החשובים ביותר בין קשרים יוניים לסוגים אחרים של קשרים כימיים הם אי-כיווניות ואי רוויה. זו הסיבה שגבישים שנוצרו עקב קשר יוני נמשכים לעבר אריזים קרובים שונים של היונים המתאימים.
מאפיין של תרכובות כאלה הוא מסיסות טובה בממיסים קוטביים (מים, חומצות וכו'). זה נובע מהחלקים הטעונים של המולקולה. במקרה זה, הדיפולים של הממס נמשכים לקצוות הטעונים של המולקולה, וכתוצאה מתנועה בראונית, הם "מושכים" את מולקולת החומר לחלקים ומקיפים אותם, ומונעים מהם להתאחד מחדש. התוצאה היא יונים מוקפים בדיפולים של הממס. 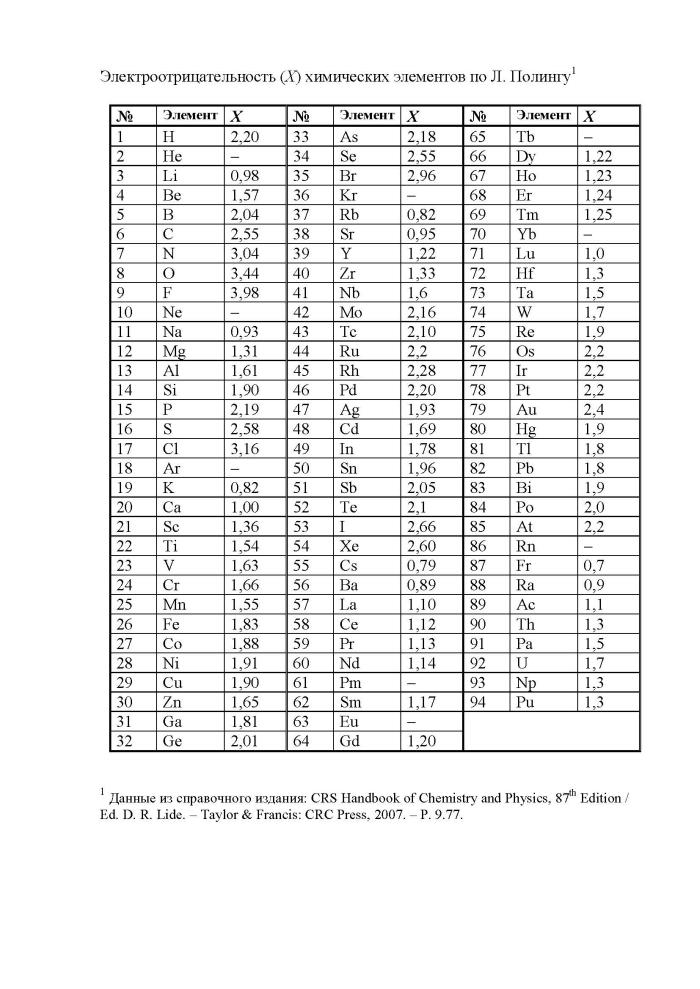
^ חיבור מתכת
קשר מתכתי הוא קשר כימי עקב נוכחותם של אלקטרונים חופשיים יחסית. זה אופייני הן למתכות טהורות והן לסגסוגות שלהן ותרכובות בין-מתכתיות.
מנגנון קשר מתכתי
יוני מתכת חיוביים ממוקמים בכל הצמתים של סריג הגביש. ביניהם באקראי, כמו מולקולות גז, אלקטרונים ערכיים נעים, מנותקים מאטומים במהלך היווצרותם של יונים. אלקטרונים אלה ממלאים את תפקיד המלט, ומחזיקים את היונים החיוביים יחד; אחרת, הסריג יתפרק תחת פעולת כוחות הדחייה בין היונים. במקביל, אלקטרונים מוחזקים גם על ידי יונים בתוך סריג הגביש ואינם יכולים לעזוב אותו. כוחות התקשורת אינם מקומיים ואינם מכוונים. לכן, ברוב המקרים מופיעים מספרי קואורדינציה גבוהים (למשל 12 או 8).
רוב המתכות יוצרות אחת מהסריגים הסימטריים ביותר הבאים בצפיפות:
מרוכז גוף מעוקב, מרוכז פנים מעוקב ומשושה.
בסריג מעוקב במרכז גוף (bcc), האטומים ממוקמים בקודקודי הקוביה ואטום אחד ממוקם במרכז נפח הקובייה. למתכות יש סריג מרוכז בגוף: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba וכו'.
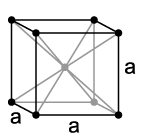
בסריג מעוקב במרכז פנים (fcc), אטומים ממוקמים בקודקודי הקובייה ובמרכז כל פנים. למתכות מסוג זה יש סריג: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co וכו'.

בסריג משושה, אטומים ממוקמים בקודקודים ובמרכז הבסיסים המשושים של המנסרה, ושלושה אטומים ממוקמים במישור האמצעי של המנסרה. למתכות יש אריזה כזו של אטומים: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca וכו'.

נכסים
אלקטרונים הנעים בחופשיות גורמים למוליכות חשמלית ותרמית גבוהה. חומרים בעלי קשר מתכתי משלבים לעתים קרובות חוזק עם משיכות, שכן כאשר אטומים נעקרים זה ביחס לזה, הקשרים אינם נשברים.
^
IV. קשר מימן
קשר מימן- צורת חיבור בין אטום אלקטרושליל לאטום מימן H הקשור בקוולנטיות לאטום אלקטרושליל אחר. N, O או F יכולים לפעול כאטומים אלקטרוניים שליליים. קשרי מימן יכולים להיות בין מולקולריים או תוך מולקולריים.
לעתים קרובות, קשר מימן נתפס כאינטראקציה אלקטרוסטטית המועצמת על ידי הגודל הקטן של המימן, המאפשר את הקרבה של הדיפולים המקיימים אינטראקציה. אחר כך הם מדברים על זה כסוג של קשר תורם-מקבל, אינטראקציה לא ערכית בין אטום המימן H, קשור קוולנטית לאטום A קבוצות א-חשל מולקולת RA-H ואטום B האלקטרוניטיבי של מולקולה אחרת (או קבוצה פונקציונלית של אותה מולקולה) BR". התוצאה של אינטראקציות כאלה הן קומפלקסים של RA-H BR" בדרגות יציבות שונות, שבהם פועל אטום המימן כ"גשר" המקשר בין שברי RA לבין BR.
המאפיינים של קשר המימן, לפיהם הוא מובחן כמין נפרד, הם החוזק הלא גבוה שלו, שכיחותו וחשיבותו, במיוחד בתרכובות אורגניות, וכן כמה תופעות לוואי הקשורות לגודל קטן והיעדר נוספות. אלקטרונים במימן.
האנרגיה של קשר מימן קטנה בהרבה מהאנרגיה של קשר קוולנטי רגיל (לא עולה על 40 קילו ג'ל/מול). עם זאת, אנרגיה זו מספיקה כדי לגרום לאסוציאציה של מולקולות, כלומר להתאגדות שלהן לדימרים או פולימרים. החיבור של מולקולות הוא שגורם לנקודות התכה ורתיחה גבוהות באופן חריג של חומרים כמו מימן פלואוריד, מים ואמוניה.
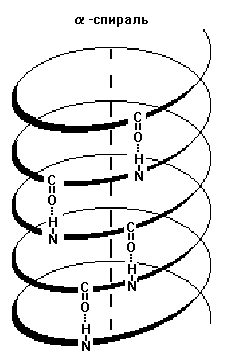
סוג זה של קשר, למרות שהוא חלש יותר מקשרים יוניים וקולנטיים, בכל זאת ממלא תפקיד חשוב מאוד באינטראקציות תוך-מולקולריות. קשרי מימן אחראים במידה רבה תכונות גשמיותמים ונוזלים אורגניים רבים (אלכוהולים, חומצות קרבוקסיליות, אמידים של חומצות קרבוקסיליות, אסטרים).
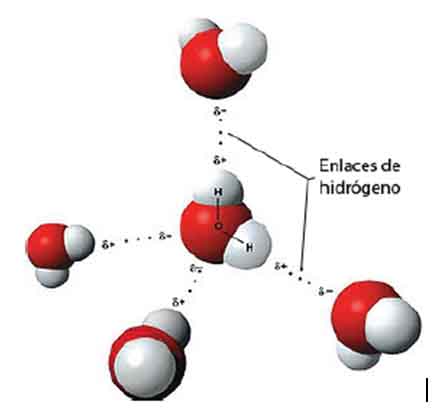
קיבולת החום הגבוהה בצורה חריגה של מים, כמו גם מוליכות תרמית של אלכוהולים רב-הידריים, מסופקת על ידי קשרי מימן רבים. מולקולת מים אחת יכולה ליצור עד ארבעה קשרי מימן קלאסיים עם שכנותיה.
קשרי מימן מגבירים את נקודת הרתיחה, הצמיגות ומתח הפנים של נוזלים. קשרי מימן אחראים לתכונות ייחודיות רבות אחרות של מים.
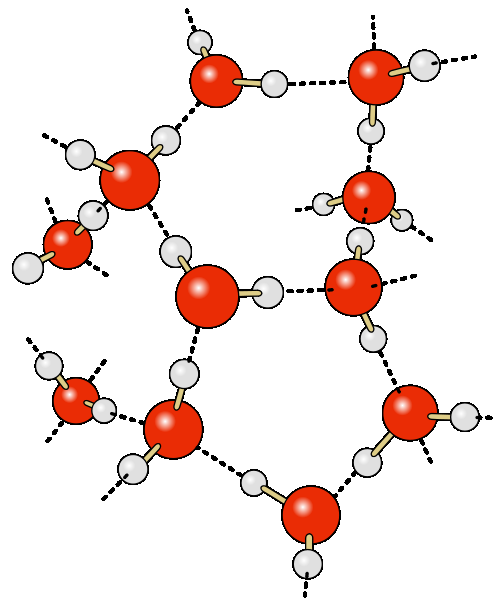
על פי תפיסות מודרניות, נוכחות של קשרי מימן בין מולקולות מים מובילה להיווצרותם של מה שנקרא צבירי מים או קומפלקסים. הדוגמה הפשוטה ביותר לאשכול כזה היא דימר מים:
מים מיוצגים כרשת של מולקולות H2O המחוברות בקשרי מימן.
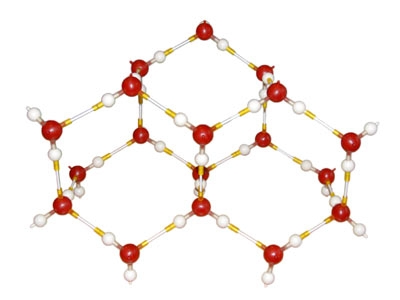
כאשר מים קופאים נוצרים קשרי מימן רבים:
![]()
קשרי מימן במולקולות קרח:
קשרי מימן בין מולקולות של חומצות אורגניות:
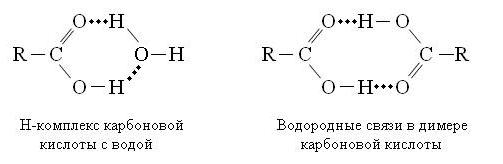
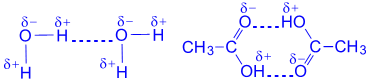
קשרי מימן בחלבונים:
קשר קוולנטי הוא קשר כימי שנוצר על ידי שיתוף של זוגות אלקטרונים.
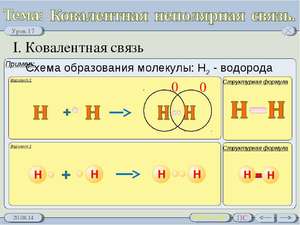
הבה נבחן את מנגנון היווצרותו של קשר קוולנטי באמצעות הדוגמה של מולקולת מימן H2. לאטומי מימן יש נוסחה אלקטרונית: 1H 1s1.
כאשר שני אטומי מימן מתקרבים זה לזה, שני אלקטרונים בעלי ספינים אנטי מקבילים (אלקטרונים מסומנים בחצים מכיוונים שונים) מקיימים אינטראקציה עם היווצרות זוג אלקטרונים משותף (משותף).
ניתן לייצג את הסכימה ליצירת קשר קוולנטי על ידי ציון האלקטרון הבלתי מזווג של הרמה החיצונית עם נקודה אחת, וזוג האלקטרונים המשותף עם שתי נקודות. זוג אלקטרונים משותף, כלומר. קשר קוולנטי, מסומן לעתים קרובות על ידי פס. זוג אלקטרונים משותף נוצר כתוצאה מחפיפה של s-orbitals של אטומי מימן, בעוד שצפיפות אלקטרונים מוגברת נוצרת באזור האורביטלים החופפים.
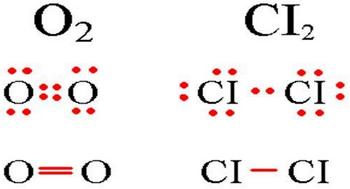
שקול את היווצרותו של קשר קוולנטי במולקולת כלור Cl2. לאטומי כלור יש נוסחה אלקטרונית: 17Cl 1s2 2s2 2p6 3s2 3p5.
לאטום הכלור יש שבעה אלקטרונים ברמת האנרגיה החיצונית שלו, כאשר אלקטרון אחד לא מזווג בתת-רמות 3p. כאשר שני אטומי כלור מחוברים יחד, אורביטלים 3p עם אלקטרונים לא מזווגים חופפים ונוצר זוג אלקטרונים משותף. לכל אטום כלור במולקולת Cl2 יש שלושה זוגות אלקטרונים לא משותפים (ששייכים לאותו אטום).
במולקולת המימן H2, כמו במולקולת הכלור Cl2, נוצר קשר פשוט (חד). יש מולקולות שבהן מופיעים שניים או שלושה זוגות אלקטרונים בין שני אטומים. קשרים קוולנטיים כאלה נקראים, בהתאמה, כפול או משולש. השם המקובל לקשרים כפולים ומשולשים הוא קשרים מרובים.
לדוגמה, שקול את היווצרותו של קשר קוולנטי במולקולת החמצן O2. לאטומי חמצן יש נוסחה אלקטרונית: 8 O 1s2 2s2 2p4.
לאטום החמצן יש שישה אלקטרונים ברמת האנרגיה החיצונית שלו, כאשר שני אלקטרונים לא מזווגים בתת-רמות 2p. ביצירת קשר כימי במולקולת O2 מעורבים שני אלקטרונים מכל אטום חמצן. במקרה זה, נוצרים שני זוגות אלקטרונים משותפים (קשר כפול). כל אטום חמצן במולקולת O2 אוגר שני זוגות אלקטרונים לא משותפים.
כאשר נוצר קשר קוולנטי במולקולת מימן, כל אחד מאטומי המימן הוא תצורה יציבה של שני אלקטרונים עקב היווצרות זוג אלקטרונים משותף. במקרים אחרים, כאשר נוצר קשר קוולנטי, למשל, במולקולות של כלור וחמצן, כל אחד מהאטומים הוא תצורה יציבה המורכבת משמונה אלקטרונים.
במקרה של כל שלוש המולקולות הנחשבות (מימן, כלור וחמצן), נוצר קשר קוולנטי בין אטומים בעלי אותה אלקטרושליליות. אינטראקציה זו נצפית במבנה חומרים פשוטים שאינם מתכתיים, שהמולקולות שלו מורכבות משני אטומים זהים. במקרה זה, זוגות אלקטרונים נפוצים ממוקמים באופן סימטרי בין גרעיני האטומים, הם מחוברים. כתוצאה מכך נוצרות מולקולות שבהן מרכזי המטענים החיוביים והשליליים חופפים.
אז, קשר קוולנטי, שנוצר בין אטומים עם אותה אלקטרושליליות עקב זוגות אלקטרונים משותפים, נקרא קשר קוולנטי לא קוטבי. יש לזכור שסוג זה של קשר כימי נוצר בחומרים פשוטים שאינם מתכתיים. כדוגמאות לחומרים בעלי סוג קשר קוולנטי לא קוטבי, ניתן למנות פלואור F2, ברום Br2, יוד I2, חנקן N2.
אם לאטומים המקיימים אינטראקציה יש אלקטרושליליות שונה (האטומים של שונים יסודות כימיים), אז זוג האלקטרונים המשותף יעבור לכיוון האטום עם האלקטרושליליות הגדולה יותר. במקרה זה נוצר מטען שלילי חלקי על אטום בעל אלקטרושליליות גבוהה יותר ומטען חיובי חלקי נוצר על אטום בעל אלקטרושליליות נמוכה יותר. מטענים חלקיים אלה פחותים מאחדות בערכם המוחלט.
לדוגמה, כאשר נוצרת מולקולת מימן כלורי HCl, ה-s-אורביטל של אטום המימן וה-p-אורביטל של אטום הכלור חופפים. צמד האלקטרונים המשותף ממוקם בצורה א-סימטרית ביחס למרכזי האטומים המקיימים אינטראקציה. זה עובר לכלור האלקטרונילי יותר.
לאטום הכלור יש מטען שלילי חלקי, ולאטום המימן מטען חיובי חלקי. במקרה זה, מרכזי המטענים החיוביים והשליליים במולקולה אינם חופפים. מולקולות כאלה נקראות קוטביות, או דיפולות. דיפול הוא מערכת של שני מטענים שווים בגודלם אך מנוגדים בסימן.
אז, קשר קוולנטי שנוצר בין אטומים שהאלקטרושליליות שלהם שונה, אך מעט, נקרא קשר קוטבי קוולנטי. יש לזכור שסוג זה של קשר כימי נוצר ב חומרים מורכביםנוצר על ידי אטומים שאינם מתכת. כדוגמאות לחומרים בעלי קשר קוטבי קוולנטי, ניתן למנות מימן פלואוריד HF, מים H2O, אמוניה NH3, מתאן CH4, תחמוצת פחמן (IV) CO2.
עבור מולקולה בעלת סוג קוולנטי של קשר כימי, ניתן לכתוב נוסחה אלקטרונית ומבנית (גרפית). הנוסחה האלקטרונית מורכבת מסמלים של יסודות כימיים, שסביבם מצוינים האלקטרונים של המפלס החיצוני בנקודות, ובין האטומים - זוגות אלקטרונים משותפים. נוסחה מבנית (גרפית) היא נוסחה שבה כל זוג אלקטרונים משותף מיוצג בפס. גם נוסחאות אלקטרוניות וגם נוסחאות מבניות מציגות את סדר התקשורת של אטומים במולקולה, את הקשר ביניהם.
זה לא סוד שהכימיה היא מדע מורכב ומגוון למדי. תגובות רבות ושונות, ריאגנטים, כימיקלים ומונחים מורכבים ובלתי מובנים אחרים - כולם מקיימים אינטראקציה זה עם זה. אבל העיקר שאנחנו מתעסקים בכימיה כל יום, לא משנה אם נקשיב למורה בשיעור ונלמד חומר חדשאו שאנחנו מבשלים תה, שבאופן כללי הוא גם תהליך כימי.
ניתן להסיק ש כימיה היא חובה, להבין אותו ולדעת כיצד פועל העולם שלנו או חלק מחלקיו הנפרדים זה מעניין, ויותר מכך, שימושי.
עכשיו אנחנו צריכים להתמודד עם מונח כזה כמו קשר קוולנטי, אשר, אגב, יכול להיות גם קוטבי וגם לא קוטבי. אגב, עצם המילה "קוולנטית" נוצרת מהמילה הלטינית "co" - יחד ו"vales" - בעלת כוח.
התרחשויות טווח
נתחיל מזה המונח "קוולנטי" הוצג לראשונה בשנת 1919 על ידי אירווינג לנגמייר -חֲתַן פְּרָס פרס נובל. המושג "קוולנטי" מרמז על קשר כימי שבו שני האטומים חולקים אלקטרונים, מה שנקרא בעלות משותפת. לפיכך, הוא נבדל, למשל, מאחד מתכתי, שבו אלקטרונים חופשיים, או מאחד יוני, שבו אחד נותן אלקטרונים לאחר. יש לציין שהוא נוצר בין לא מתכות.
בהתבסס על האמור לעיל, אנו יכולים להסיק מסקנה קטנה לגבי מהו תהליך זה. היא נוצרת בין אטומים עקב היווצרותם של זוגות אלקטרונים משותפים, וזוגות אלו נוצרים על תת-הרמות החיצוניות והטרום-חיצוניות של אלקטרונים.
דוגמאות, חומרים עם קוטב:
סוגי קשר קוולנטי
כמו כן מבחינים בין שני סוגים - אלו הם קשרים קוטביים, ובהתאם, קשרים לא קוטביים. ננתח את התכונות של כל אחד מהם בנפרד.
קוטבי קוולנטי - חינוך
מהו המונח "קוטבי"?
 בדרך כלל קורה שלשני אטומים יש אלקטרושליליות שונה, לכן, אלקטרונים נפוצים אינם שייכים להם באותה מידה, אבל הם תמיד קרובים יותר לאחד מאשר לשני. לדוגמה, מולקולה של מימן כלורי, שבה האלקטרונים של הקשר הקוולנטי ממוקמים קרוב יותר לאטום הכלור, שכן האלקטרושליליות שלו גבוהה מזו של המימן. עם זאת, במציאות, ההבדל במשיכה של האלקטרונים קטן מספיק עבור העברה מלאה של אלקטרון ממימן לכלור.
בדרך כלל קורה שלשני אטומים יש אלקטרושליליות שונה, לכן, אלקטרונים נפוצים אינם שייכים להם באותה מידה, אבל הם תמיד קרובים יותר לאחד מאשר לשני. לדוגמה, מולקולה של מימן כלורי, שבה האלקטרונים של הקשר הקוולנטי ממוקמים קרוב יותר לאטום הכלור, שכן האלקטרושליליות שלו גבוהה מזו של המימן. עם זאת, במציאות, ההבדל במשיכה של האלקטרונים קטן מספיק עבור העברה מלאה של אלקטרון ממימן לכלור.
כתוצאה מכך, בקוטביות, צפיפות האלקטרונים עוברת לאלקטרושלילית יותר, ומטען שלילי חלקי מתעורר עליה. בתורו, לגרעין, שהאלקטרושליליות שלו נמוכה יותר, יש, בהתאם, מטען חיובי חלקי.
אנחנו מסיקים:קוטבי נוצר בין לא-מתכות שונות, הנבדלות בערך האלקטרוניטיביות, ואלקטרונים ממוקמים קרוב יותר לגרעין עם אלקטרושליליות גדולה יותר.
אלקטרונית שלילית - היכולת של אטומים מסוימים למשוך אלקטרונים של אחרים, ובכך ליצור תגובה כימית.
דוגמאות לקוטב קוולנטי, חומרים בעלי קשר קוטבי קוולנטי:
הנוסחה של חומר בעל קשר קוטבי קוולנטי
קוולנטי לא קוטבי, הבדל בין קוטבי ללא קוטבי
ולבסוף, לא קוטבי, בקרוב נגלה מה זה.
ההבדל העיקרי בין לא קוטבי לקוטביהיא סימטריה. אם, במקרה של קשר קוטבי, האלקטרונים היו ממוקמים קרוב יותר לאטום אחד, אז עם קשר לא קוטבי, האלקטרונים מסודרים באופן סימטרי, כלומר, שווה בשווה ביחס לשניהם.
ראוי לציין כי לא קוטבי נוצר בין אטומים שאינם מתכת של יסוד כימי אחד.
לדוגמה, חומרים בעלי קשרים קוולנטיים לא קוטביים:
כמו כן, קבוצה של אלקטרונים נקראת לעתים קרובות פשוט ענן אלקטרונים, על סמך זה אנו מסיקים שענן האלקטרונים של התקשורת, היוצר זוג משותף של אלקטרונים, מופץ בחלל באופן סימטרי, או באופן שווה ביחס לגרעין של שניהם.
דוגמאות לקשר לא קוטבי קוולנטי וסכימה ליצירת קשר לא קוטבי קוולנטי
אבל זה גם שימושי לדעת להבחין בין קוטבי קוולנטי ללא קוטבי.
קוולנטי לא קוטביהם תמיד אטומים של אותו חומר. H2. CL2.
המאמר הזה הגיע לסיומו, עכשיו אנחנו יודעים מהו התהליך הכימי הזה, אנחנו יודעים לקבוע אותו ואת הזנים שלו, אנחנו מכירים את הנוסחאות ליצירת חומרים, ובכלל עוד קצת על העולם המורכב שלנו, הצלחה ב כימיה ויצירת נוסחאות חדשות.
המונח "קשר קוולנטי" עצמו מגיע משתי מילים לטיניות: "קו" - ביחד ו"ועלים" - בעל כוח, שכן זהו קשר המתרחש עקב זוג אלקטרונים השייכים לשניהם בו זמנית (או, ב מונחים פשוטים יותר, קשר בין אטומים עקב זוגות אלקטרונים המשותפים להם). יצירת קשר קוולנטי מתרחשת אך ורק בין אטומים של לא-מתכות, והוא יכול להופיע גם באטומים של מולקולות וגם בגבישים.
הקוולנטי הקוולנטי התגלה לראשונה עוד בשנת 1916 על ידי הכימאי האמריקאי ג'יי לואיס ובמשך זמן מה היה קיים בצורה של השערה, רעיון, רק אז הוא אושר בניסוי. מה גילו עליה כימאים? והעובדה שהאלקטרושליליות של לא-מתכות יכולה להיות די גדולה ובמהלך האינטראקציה הכימית של שני אטומים העברת אלקטרונים מאחד לשני עשויה להיות בלתי אפשרית, ברגע זה האלקטרונים של שני האטומים מתחברים, ממש נוצר ביניהם קשר קוולנטי של אטומים.
סוגי קשר קוולנטי
באופן כללי, ישנם שני סוגים של קשר קוולנטי:
- לְהַחלִיף,
- תורם-מקבל.
עם סוג החלפה של קשר קוולנטי בין אטומים, כל אחד מהאטומים המחברים מייצג אלקטרון אחד לא מזווג ליצירת קשר אלקטרוני. במקרה זה, האלקטרונים הללו חייבים להיות בעלי מטענים הפוכים (ספינים).
דוגמה לקשר קוולנטי כזה יהיו הקשרים המתרחשים במולקולת המימן. כאשר אטומי מימן מתקרבים זה לזה, ענני האלקטרונים שלהם חודרים זה לזה, במדע זה נקרא חפיפה של ענני אלקטרונים. כתוצאה מכך, צפיפות האלקטרונים בין הגרעינים עולה, הם עצמם נמשכים זה לזה, והאנרגיה של המערכת יורדת. עם זאת, כאשר מתקרבים מדי, הגרעינים מתחילים להדוף זה את זה, וכך יש ביניהם מרחק אופטימלי כלשהו.
זה מוצג בצורה ברורה יותר בתמונה.

באשר לסוג הקשר הקוולנטי התורם-מקבל, הוא מתרחש כאשר חלקיק אחד, במקרה זה התורם, מציג את צמד האלקטרונים שלו עבור הקשר, והשני, המקבל, מציג אורביטל חופשי.
כמו כן מדברים על סוגי הקשרים הקוולנטיים, ניתן להבחין בקשרים קוולנטיים לא קוטביים וקוטביים, נכתוב עליהם בפירוט רב יותר להלן.
קשר קוולנטי לא קוטבי
ההגדרה של קשר קוולנטי לא קוטבי היא פשוטה; זהו קשר שנוצר בין שני אטומים זהים. דוגמה ליצירת קשר קוולנטי לא קוטבי, ראה את התרשים שלהלן.
תרשים של קשר קוולנטי לא קוטבי.
במולקולות בעלות קשר לא קוטבי קוולנטי, זוגות אלקטרונים נפוצים ממוקמים במרחקים שווים מגרעיני האטומים. לדוגמה, במולקולת החמצן (בתרשים למעלה), האטומים מקבלים תצורה של שמונה אלקטרונים, בעוד שהם חולקים ארבעה זוגות אלקטרונים.
חומרים בעלי קשר קוולנטי לא קוטבי הם בדרך כלל גזים, נוזלים או מוצקים נמסים יחסית.
קשר קוטבי קוולנטי
עכשיו בואו נענה על השאלה איזה קשר הוא קוטבי קוולנטי. אז, קשר קוטבי קוולנטי נוצר כאשר לאטומים הקשורים קוולנטיים יש אלקטרושליליות שונה, והאלקטרונים הציבוריים אינם שייכים באותה מידה לשני אטומים. רוב הזמן, אלקטרונים ציבוריים קרובים יותר לאטום אחד מאשר לאחר. דוגמה לקשר קוטבי קוולנטי הוא הקשר המתרחש במולקולת מימן כלורי, כאשר האלקטרונים הציבוריים האחראים ליצירת קשר קוולנטי ממוקמים קרוב יותר לאטום הכלור מאשר מימן. והעניין הוא שלכלור יש יותר אלקטרושליליות מאשר למימן.

כך נראה קשר קוולנטי קוטבי.
דוגמה בולטת לחומר עם קשר קוולנטי קוטבי היא מים.
כיצד לקבוע קשר קוולנטי
ובכן, עכשיו אתה יודע את התשובה לשאלה כיצד לקבוע קשר קוטבי קוולנטי, וכקשר לא קוטבי, בשביל זה מספיק לדעת את התכונות והן נוסחה כימיתמולקולות, אם מולקולה זו מורכבת מאטומים של יסודות שונים, אז הקשר יהיה קוטבי, אם מיסוד אחד, אז לא קוטבי. חשוב גם לזכור שקשרים קוולנטיים באופן כללי יכולים להתרחש רק בין לא מתכות, זה נובע מעצם המנגנון של קשרים קוולנטיים שתואר לעיל.
קשר קוולנטי, וידאו
ובסוף הרצאת הווידאו על נושא המאמר שלנו, הקשר הקוולנטי.
