תכונות פיזיקליות של לא מתכות עם דוגמאות. לא מתכות. מאפיינים כלליים. מבנה האטום. תכונות גשמיות
>> כימיה: חומרים פשוטים- לא מתכות
לא מתכות - אלו יסודות כימיים היוצרים בצורה חופשית חומרים פשוטים שאין להם תכונות פיזיקליות של מתכות. מתוך 109 יסודות כימיים 87 הן מתכות, 22 הן לא מתכות.
6. יחסיות החלוקה של חומרים פשוטים למתכות ולא-מתכות.
שקול את האטימולוגיה של השמות של מתכות אצילות בודדות.
מדוע הביטוי הפיוטי אינו נכון מבחינה כימית: "היה ריח של רעם באוויר"?
רשום את הסכמות ליצירת מולקולות: Na2, Br2, O2, N2. מהו סוג הקשר במולקולות אלו?
תוכן השיעור סיכום שיעורתמיכה מסגרת שיעור מצגת שיטות האצה טכנולוגיות אינטראקטיביות תרגול משימות ותרגילים סדנאות בדיקה עצמית, הדרכות, מקרים, קווסטים שאלות דיון שיעורי בית שאלות רטוריות של תלמידים איורים אודיו, וידאו קליפים ומולטימדיהתצלומים, תמונות גרפיקה, טבלאות, תוכניות הומור, אנקדוטות, בדיחות, משלי קומיקס, אמרות, תשבצים, ציטוטים תוספות תקציריםמאמרים שבבים עבור גיליונות רמאות סקרנים ספרי לימוד בסיסי ומילון מונחים נוסף של מונחים אחרים שיפור ספרי לימוד ושיעוריםתיקון שגיאות בספר הלימודעדכון קטע בספר הלימוד אלמנטים של חדשנות בשיעור החלפת ידע מיושן בחדש רק למורים שיעורים מושלמיםתוכנית לוח שנה לשנה המלצות מתודולוגיות של תוכנית הדיון שיעורים משולביםלא-מתכות הם יסודות כימיים היוצרים בצורה חופשית חומרים פשוטים שאין להם תכונות פיזיקליות של מתכות. מתוך 114 היסודות הכימיים, 92 הם מתכות, 22 הם לא מתכות. לא-מתכות הם חומרים פשוטים, בתנאים רגילים הם יכולים להיות גזים, נוזלים ומוצקים (איור 46).
אורז. 46.
חומרים פשוטים - לא מתכות
ניסוי מעבדה מס' 6
היכרות עם אוסף הלא מתכות
חקור את אוסף הלא מתכות. רשמו את הנוסחאות הכימיות של הלא-מתכות שניתנו לכם, סדרו אותן בסדר עולה:
- צְפִיפוּת;
- קַשִׁיוּת;
- זוהר;
- עוצמת השינוי בצבע.
להשלמת המשימה, השתמש בנספחים 1 ו-2, מקורות מידע נוספים.
הגזים הם הליום He, Neon Ne, argon Ar, Krypton Kr, Xenon Xe, Radon Rn. הם נקראים גזים אינרטיים. מולקולות של גז אינרטי מורכבות מאטום אחד. בשכבת האלקטרונים החיצונית, לאטומים של גזים אינרטיים (למעט הליום) יש שמונה אלקטרונים. להליום יש שניים. ביציבותם הכימית, גזים אינרטים דומים למתכות אצילות - זהב ופלטינה, ויש להם שם שני - גזים אצילים. שם זה מתאים יותר לגזים אינרטיים, אשר בכל זאת נכנסים לפעמים תגובה כימיתויוצרים תרכובות. ב-1962 הופיעה הודעה שהושגה תרכובת של קסנון עם פלואור. כיום ידועות יותר מ-150 תרכובות של קסנון, קריפטון, ראדון עם פלואור, חמצן, כלור וחנקן.
הרעיון של הבלעדיות הכימית של גזים אצילים התברר כלא עקבי, ולכן, במקום קבוצת האפס כביכול, הוצבו גזים אינרטים בקבוצה VIII (קבוצה VIIIA) בטבלה של D.I. Mendeleev.
הליום, שהוא שני רק למימן בקלילות, אך בניגוד לאחרון אינו דליק, כלומר אינו מהווה סכנת שריפה, מלא בבלונים ובספינות אוויר (איור 47).

אורז. 47.
בלונים וספינות אוויר מתמלאים בהליום
ניאון משמש לייצור פרסום מואר (איור 48). זכרו את הביטוי הפיגורטיבי "רחובות העיר הוצפו בניאון".

גזים מימן, חמצן, חנקן, כלור, פלואור יוצרים מולקולות דו-אטומיות, בהתאמה - H 2 , O 2 , N 2 , Cl 2 , F 2 .
הרכב החומר מתואר בכתב באמצעות סימנים ומספרים כימיים - מדדים, באמצעות נוסחה כימית. לפי הנוסחה הכימית, כפי שאתה כבר יודע, משקלו המולקולרי היחסי של חומר (Mr) מחושב. המסה המולקולרית היחסית של חומר פשוט שווה למכפלת המסה האטומית היחסית במספר האטומים במולקולה, למשל חמצן O 2:
Mr(02) = Ar(0) × 2 = 16 × 2 = 32.
עם זאת, היסוד חמצן יוצר עוד חומר פשוט גזי - אוזון, שהמולקולות שלו מכילות כבר שלושה אטומי חמצן. הנוסחה הכימית של אוזון היא 0 3, ומשקלו המולקולרי היחסי הוא: Mr(03) = 16 × 3 = 48.
המאפיינים של שינויים אלוטרופיים של היסוד הכימי חמצן - חומרים פשוטים של חמצן O 2 ואוזון O 3 - שונות. החמצן הוא חסר ריח, אבל לאוזון יש ריח (מכאן שמו - ביוונית פירושו של אוזון הוא "ריח"). ריח זה, ניחוח הרעננות, ניתן לחוש בסופת רעמים, שכן אוזון נוצר בכמויות קטנות באוויר כתוצאה מפריקות חשמל.
חמצן הוא גז חסר צבע, ואילו לאוזון יש צבע סגול חיוור. האוזון הוא יותר קוטל חיידקים (lat. qidao - להרוג) מאשר חמצן. לכן, אוזון משמש לחיטוי מי שתייה. האוזון מסוגל לשמר את הקרניים האולטרה סגולות של ספקטרום השמש, המזיקות לכל החיים על פני כדור הארץ, ולכן שכבת האוזון, הממוקמת באטמוספירה בגובה של 20-35 ק"מ, מגינה על החיים על הפלנטה שלנו (בתמונה 49). אתה רואה תצלום שצולם מהחלל באמצעות לוויין מלאכותי כדור הארץ שבו אזורים של אוזון נמוך באטמוספירה ("חורי אוזון") מסומנים בלבן).
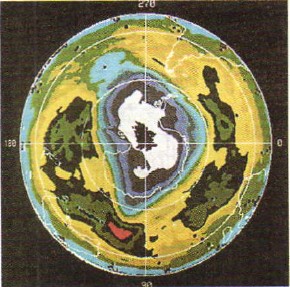
אורז. 49.
"חורי אוזון" באטמוספירה של כדור הארץ
מבין החומרים הפשוטים - לא מתכות בתנאים רגילים, רק ברום הוא נוזל, שהמולקולות שלו הן דו-אטומיות. הנוסחה של ברום היא Br 2. זהו נוזל חום כבד עם ריח לא נעים (מכאן השם, שכן ברומוס מתורגם מיוונית עתיקה כ"מסריח").
כמה חומרים מוצקים - שאינם מתכות ידועים עוד מימי קדם - אלו הם גופרית ופחמן (בצורת פחם, יהלום וגרפיט).
במוצקים - לא מתכות, נצפית גם תופעת האלוטרופיה. אז, היסוד פחמן יוצר חומרים פשוטים כאלה, שונים במראה, כמו יהלום, גרפיט (איור 50). הסיבה להבדל בתכונות של יהלום וגרפיט היא מבנה סריגי הגביש של החומרים הללו, אותם תשקול מעט מאוחר יותר.
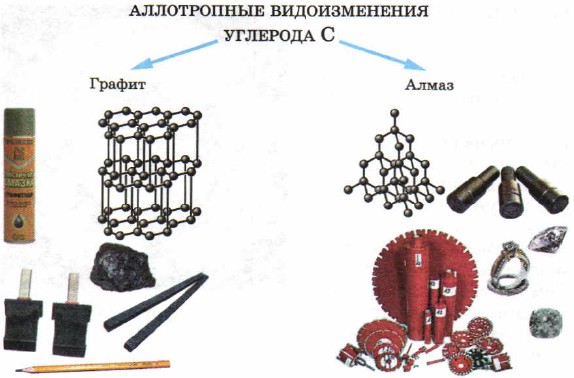
אורז. חמישים.
שינויים אלוטרופיים של פחמן ויישומיו
ליסוד זרחן שני שינויים אלוטרופיים: זרחן אדום (הם מכסים את הצד של קופסת גפרורים) וזרחן לבן. לאחרון יש מולקולה ארבע אטומית, ההרכב שלה משתקף בנוסחה P 4 .
חומר מוצק - לא מתכת הוא יוד גבישי עם מולקולה דיאטומית I 2 . אל תבלבלו אותו עם תמיסת אלכוהול של יוד - תמיסת יוד שזמינה בכל ערכת עזרה ראשונה ביתית.
יוד גבישי וגרפיט אינם כמו חומרים פשוטים אחרים - שאינם מתכות, יש להם ברק מתכתי.
כדי להראות את היחסיות של החלוקה של חומרים פשוטים על סמך תכונותיהם הפיזיקליות למתכות ולא-מתכות, שקול את האלוטרופיה של היסוד הכימי בדיל Sn. בטמפרטורת החדר, בטא-טין (β-Sn) קיים בדרך כלל. זהו הפח הלבן הידוע - המתכת ממנה היו יצוקים חיילי פח (איור 51, א) (זכור את האגדה של ח.ק. אנדרסן "חייל הפח האיתן"). הפח מצופה בחלק הפנימי של קופסאות פח (איור 51, ב). זה חלק מסגסוגת ידועה כמו ברונזה, כמו גם הלחמה (איור 51, ג).

אורז. 51.
יישומים של פח:
א - צעצועים; ב - ייצור פחיות; c - הלחמה
בטמפרטורות מתחת ל-13.2 מעלות צלזיוס, אלפא-פח (α-Sn) יציב יותר - אבקה אפורה גרגירים עדינים, שיש לה תכונות של לא מתכת. תהליך הפיכת הפח הלבן לאפור הוא המהיר ביותר בטמפרטורה השווה ל-33 מעלות צלזיוס. טרנספורמציה זו קיבלה את השם הפיגורטיבי "מכת פח".
עכשיו בואו נשווה בין חומרים פשוטים - מתכות ולא מתכות באמצעות טבלה 3.
שולחן 3
חומרים פשוטים

מילות מפתח וביטויים
- גזים אצילים.
- אלוטרופיה ושינויים אלוטרופיים, או שינויים.
- חמצן ואוזון.
- יהלום וגרפיט.
- זרחן אדום ולבן.
- פח לבן ואפור.
- היחסות של חלוקת חומרים פשוטים למתכות ולא-מתכות.
עבודה עם מחשב
- עיין בבקשה האלקטרונית. למד את החומר של השיעור והשלם את המשימות המוצעות.
- חפש באינטרנט כתובות דוא"ל שיכולות לשמש כמקורות נוספים החושפים את תוכן מילות המפתח והביטויים של הפסקה. הציעו למורה את עזרתכם בהכנת שיעור חדש - ערכו דיווח על מילות המפתח והביטויים של הפסקה הבאה.
שאלות ומשימות
- שקול את האטימולוגיה של השמות של גזים אצילים בודדים.
- מדוע הביטוי הפיוטי "היה ריח של רעם באוויר" אינו נכון מבחינה כימית?
- רשום את הסכמות ליצירת מולקולות: Na 2, Br 2, O 2, N 2. מהו סוג הקשר הכימי במולקולות אלו?
- איזה סוג של קשר כימי צריך להיות במימן מתכתי?
- משלחתו של חוקר הקוטב ר' סקוט לקוטב הדרומי בשנת 1912 נספתה בשל העובדה שאיבדה את כל אספקת הדלק: היא הייתה במיכלים אטומים בפח. איזה תהליך כימי עמד מאחורי זה?
הרצאה 3. לא מתכות
1. מאפיינים כללייםאלמנטים שאינם מתכת
ישנם רק 16 יסודות כימיים שאינם מתכתיים, אך שניים מהם, חמצן וסיליקון, מהווים 76% ממסת קרום כדור הארץ. לא-מתכות מהוות 98.5% ממסת הצמחים ו-97.6% מהמסה של אדם. פחמן, מימן, חמצן, גופרית, זרחן וחנקן הם כולם חומר אורגניהם מרכיבי החיים. מימן והליום הם היסודות העיקריים של היקום, כל אובייקטי החלל, כולל השמש שלנו, מורכבים מהם. אי אפשר לדמיין את חיינו ללא תרכובות שאינן מתכתיות, במיוחד אם נזכור שהחיוני תרכובת כימיתמים מורכבים ממימן וחמצן.
לא-מתכות הם יסודות כימיים שהאטומים שלהם מקבלים אלקטרונים כדי להשלים את רמת האנרגיה החיצונית, ובכך ליצור יונים טעונים שליליים.
כמעט לכל הלא-מתכות יש רדיוסים קטנים יחסית ומספר רב של אלקטרונים ברמת האנרגיה החיצונית מ-4 עד 7, הם מאופיינים באלקטרושליליות גבוהה ובתכונות חמצון.
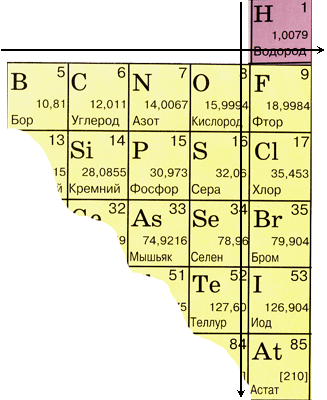
1.1. מיקומם של יסודות שאינם מתכתיים במערכת המחזורית של יסודות כימיים של מנדלייב
אם נצייר אלכסון מבורון לאסטטין במערכת המחזורית, אזי יסודות שאינם מתכתיים יהיו ממוקמים כלפי מעלה באלכסון מימין, ומתכות מלמטה משמאל, אלה כוללים גם יסודות מכל תת-הקבוצות הצדדיות, לנתנידים ואקטינידים. אלמנטים הממוקמים ליד האלכסון, למשל, בריליום, אלומיניום, טיטניום, גרמניום, אנטימון, בעלי אופי כפול והם מטלואידים. יסודות שאינם מתכת: יסוד s - מימן; p-אלמנטים של קבוצה 13 - בורון; 14 קבוצות - פחמן וסיליקון; קבוצה 15 - חנקן, זרחן וארסן, קבוצה 16 - חמצן, גופרית, סלניום וטלוריום וכל היסודות מקבוצה 17 - פלואור, כלור, ברום, יוד ואסטטין. אלמנטים של קבוצה 18 - גזים אינרטים, תופסים מיקום מיוחד, יש להם שכבת אלקטרונים חיצונית מלאה לחלוטין ותופסים מיקום ביניים בין מתכות ללא מתכות. לפעמים הם מכונים לא-מתכות, אבל באופן רשמי, על פי מאפיינים פיזיים.
1.2. מבנה אלקטרוני של אלמנטים שאינם מתכת
כמעט לכל היסודות הלא-מתכתיים ברמת האנרגיה החיצונית יש מספר רב של אלקטרונים - מ-4 עד 7. היסוד בורון הוא אנלוגי לאלומיניום, יש לו רק 3 אלקטרונים ברמת האנרגיה החיצונית, אבל יש לו רדיוס קטן, מחזיק בחוזקה את האלקטרונים שלו ויש לו תכונות של לא מתכת. הבה נציין במיוחד את המבנה האלקטרוני של המימן. זהו יסוד s, אבל הוא מקבל אלקטרון אחד די בקלות, יוצר יון הידריד ומציג את תכונות החמצון של מתכת.
תצורות אלקטרוניות של אלקטרוני ערכיות של יסודות שאינם מתכת ניתנות בטבלה:
1.3. דפוסים בשינוי המאפיינים של אלמנטים שאינם מתכת
הבה נבחן כמה דפוסים בשינוי במאפיינים של יסודות שאינם מתכתיים השייכים לאותה תקופה ולאותה קבוצה בהתבסס על מבנה האטומים שלהם.
בתקופה:
המטען הגרעיני גדל
רדיוס האטום יורד
מספר האלקטרונים ברמת האנרגיה החיצונית עולה,
האלקטרושליליות עולה
תכונות החמצון משופרות,
תכונות לא מתכתיות משופרות.
בקבוצה:
המטען הגרעיני גדל
רדיוס האטום גדל
מספר האלקטרונים ברמת האנרגיה החיצונית אינו משתנה,
האלקטרושליליות פוחתת
תכונות החמצון נחלשות,
תכונות לא מתכתיות נחלשות.
לפיכך, ככל שהיסוד במערכת המחזורית ימינה וגבוה יותר, כך תכונותיו הלא מתכתיות בולטות יותר.
- זוהי היכולת לקטב קשר כימי, למשוך זוגות אלקטרונים משותפים לעבר עצמו.
22 יסודות מסווגים כלא-מתכות.
מיקומם של יסודות לא מתכתיים בטבלה המחזורית של יסודות כימיים
| קְבוּצָה | אני | III | IV | V | VI | VII | ח |
| תקופה 1 | ח | הוא | |||||
| תקופה 2 | בְּ | מ | נ | O | ו | לא | |
| תקופה 3 | סִי | פ | ס | CL | Ar | ||
| תקופה 4 | כפי ש | Se | בר | kr | |||
| תקופה 5 | Te | אני | Xe | ||||
| תקופה 6 | בְּ | Rn |
מבנה האטומים של לא-מתכות
מאפיין אופייני של לא-מתכות הוא מספר גדול יותר (בהשוואה למתכות) של אלקטרונים ברמת האנרגיה החיצונית של האטומים שלהם. זה קובע את היכולת הגדולה יותר שלהם להוסיף אלקטרונים נוספים ולהפגין פעילות חמצונית גבוהה יותר מאשר מתכות. תכונות חמצון חזקות במיוחד, כלומר, היכולת לצרף אלקטרונים, מוצגות על ידי לא-מתכות שנמצאות בתקופות ה-2 וה-3 של קבוצות VI-VII. אם נשווה את סידור האלקטרונים באורביטלים באטומים של פלואור, כלור והלוגנים אחרים, אז נוכל גם לשפוט את תכונותיהם הייחודיות. לאטום הפלואור אין אורביטלים חופשיים. לכן, אטומי פלואור יכולים להראות רק ערכיות I ומצב חמצון - 1. חומר החמצון החזק ביותר הוא פלוּאוֹר. באטומים של הלוגנים אחרים, למשל, באטום הכלור, ישנם ד-אורביטלים חופשיים באותה רמת אנרגיה. בשל כך, התכלות של אלקטרונים יכולה להתרחש בשלוש דרכים שונות. במקרה הראשון, כלור יכול להפגין מצב חמצון של +3 וליצור חומצה הידרוכלורית HClO 2, התואמת למלחים - כלוריטים, למשל, אשלגן כלוריט KClO 2. במקרה השני, כלור יכול ליצור תרכובות שבהן מצב החמצון של הכלור הוא +5. תרכובות כאלה כוללות חומצה כלורית HClO 3 ומלחיה, כלורטים, למשל, אשלגן כלורט KClO 3 (מלח ברטולט). במקרה השלישי, כלור מפגין מצב חמצון של +7, למשל בחומצה פרכלורית HClO 4 ובמלחיה, פרכלורטים (באשלגן פרכלורט KClO 4).מבנים של מולקולות שאינן מתכתיות. תכונות פיזיקליות של לא מתכות
במצב גזי בטמפרטורת החדר הם:· מימן - H 2;
· חנקן, N 2;
· חמצן - O 2;
· פלואור - F 2;
· כלור - CI 2 .
וגזים אינרטיים:· הליום - הוא;
· ניאון - Ne;
· ארגון - Ar;
· קריפטון, Kr;
· קסנון - Xe;
· ראדון - Rn).
בְּ נוזל- ברום - בר.בְּ מוצק:
טלוריום - Te;
· יוד - אני;
· אסטטין - At.
ללא מתכות יש גם ספקטרום עשיר בהרבה של צבעים: אדום עבור זרחן, חום עבור ברום, צהוב עבור גופרית, צהוב-ירוק עבור כלור, סגול עבור אדי יוד וכו'.לא-מתכות האופייניות ביותר יש מבנה מולקולרי, בעוד שלפחות אופייניות יש מבנה לא מולקולרי. זה מסביר את ההבדל בתכונות שלהם.
הרכב ותכונות של חומרים פשוטים - לא מתכות
לא-מתכות יוצרות מולקולות מונוטומיות ודיאטומיות כאחד. ל מונוטומי לא-מתכות כוללות גזים אינרטיים שלמעשה אינם מגיבים אפילו עם החומרים הפעילים ביותר. גזים אינרטיים ממוקמים בקבוצה VIII של המערכת המחזורית, והנוסחאות הכימיות של החומרים הפשוטים המתאימים הם כדלקמן: He, Ne, Ar, Kr, Xe ו-Rn.
נוצרות כמה לא מתכות דיאטומי מולקולות. אלה הם H 2, F 2, Cl 2, Br 2, Cl 2 (יסודות מקבוצה VII של המערכת המחזורית), כמו גם חמצן O 2 וחנקן N 2. מ טריאטומי מולקולות מורכבות מגז אוזון (O 3). עבור חומרים שאינם מתכתיים הנמצאים במצב מוצק, די קשה ליצור נוסחה כימית. אטומי הפחמן בגרפיט מחוברים זה לזה בדרכים שונות. קשה לבודד מולקולה בודדת במבנים הנתונים. כשכותבים נוסחאות כימיותחומרים כאלה, כמו במקרה של מתכות, מובאת ההנחה שחומרים כאלה מורכבים רק מאטומים. במקביל נכתבות נוסחאות כימיות ללא מדדים: C, Si, S וכו'. חומרים פשוטים כמו אוזון וחמצן, בעלי אותו הרכב איכותי (שניהם מורכבים מאותו יסוד - חמצן), אך שונים במספר האטומים. במולקולה יש תכונות שונות. לכן, לחמצן אין ריח, בעוד לאוזון יש ריח חריף שאנו מרגישים במהלך סופת רעמים. המאפיינים של לא-מתכות מוצקות, גרפיט ויהלום, שגם להם יש את אותו הרכב איכותי אך מבנה שונה, נבדלות בחדות (גרפיט שביר, יהלום קשה). לפיכך, תכונותיו של חומר נקבעות לא רק על ידי ההרכב האיכותי שלו, אלא גם על ידי כמה אטומים מכילים מולקולת חומר וכיצד הם מחוברים זה לזה. לא-מתכות בצורת גופים פשוטים נמצאים במצב מוצק או גזי (למעט ברום - נוזל). אין להם תכונות פיזיקליות של מתכות. לא-מתכות מוצקות אין את הברק האופייני למתכות, הן לרוב שבירות, מוליכות חשמל וחום גרוע (למעט גרפיט). לבורון B גבישי (כמו סיליקון גבישי) יש נקודת התכה גבוהה מאוד (2075 מעלות צלזיוס) וקשיות גבוהה. המוליכות החשמלית של בורון עולה מאוד עם עליית הטמפרטורה, מה שמאפשר להשתמש בו באופן נרחב בטכנולוגיית מוליכים למחצה. הוספת בורון לפלדה וסגסוגות של אלומיניום, נחושת, ניקל וכו' משפרת את תכונותיהם המכניות. בורידים (תרכובות של בורון עם כמה מתכות, למשל, עם טיטניום: TiB, TiB 2) נחוצים בייצור חלקי מנועי סילון, להבי טורבינת גז. כפי שניתן לראות מתכנית 1, פחמן הוא C, סיליקון הוא Si, ובורון הוא B בעלי מבנה דומה ויש להם כמה תכונות משותפות. כחומרים פשוטים, הם מתרחשים בשני שינויים - גבישי ואמורפי. השינויים הגבישיים של יסודות אלה קשים מאוד, עם נקודות התכה גבוהות. לסיליקון גבישי יש תכונות מוליכים למחצה. כל היסודות הללו יוצרים תרכובות עם מתכות - קרבידים, סיליקידים ובורידים (CaC 2, Al 4 C 3, Fe 3 C, Mg 2 Si, TiB, TiB 2). לחלקם יש קשיות גדולה יותר, כגון Fe 3 C, TiB. סידן קרביד משמש לייצור אצטילן.